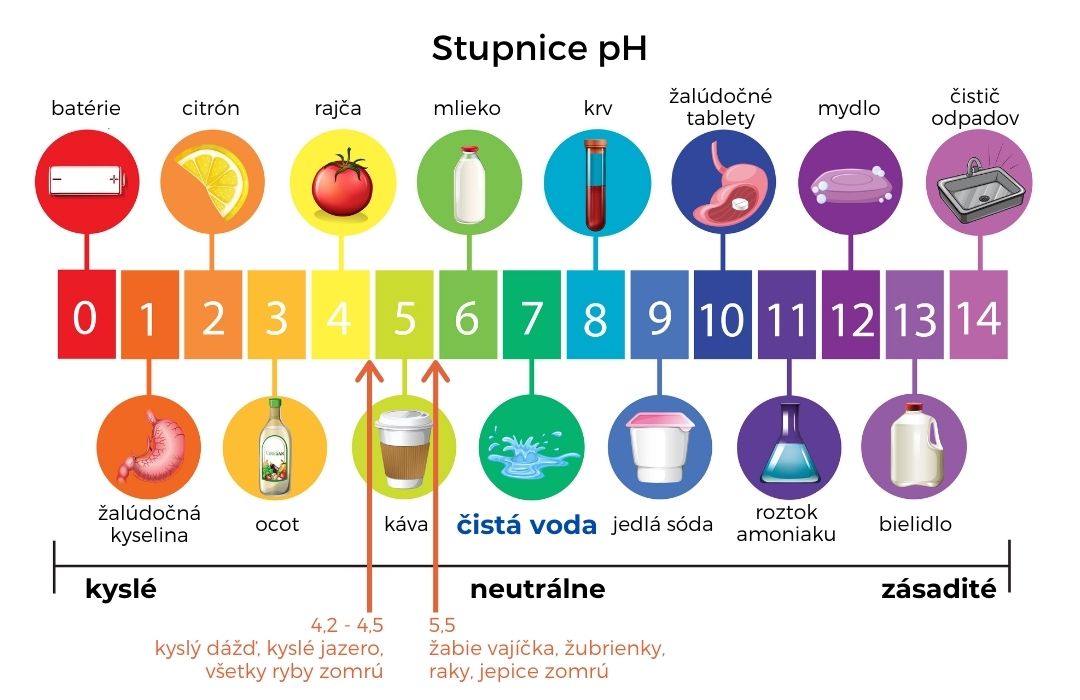
Čo spôsobuje kyslosť a zásaditosť rôznych vodných roztokov? Meranie ich pH hodnôt.
Oblasť skúmania
Čo rozhoduje o tom či je vodný roztok látky kyslý, neutrálny alebo zásaditý a ako to vieme zistiť?
Teoretická časť
Každý vodný roztok obsahuje H+ ióny, ktoré sa nevyskytujú vo voľnej forme, ale v roztoku sa nachádzajú v hydratovanej forme (najmä H3O+ - oxóniový katión). V závislosti od koncentrácie a typu rozpustených zlúčenín, koncentrácia H3O+ vo vodných roztokoch sa môže meniť vo veľmi širokom intervale (1 až 1×10-14 mol l-1). Samotná voda podlieha autoprotolýze podľa rovnice:
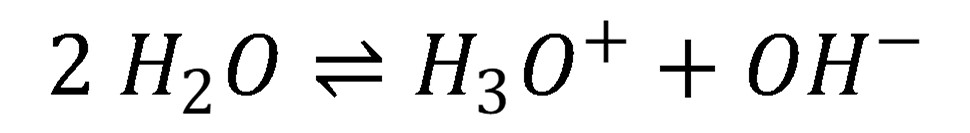 (1)
(1)
Pre túto rovnicu platí rovnovážna konštanta:
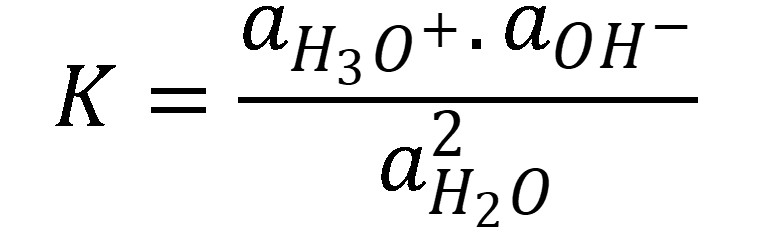 (2)
(2)
Keďže aktivita (resp. koncentrácia=55,5 mol l-1) vody v zriedených roztokoch je v porovnaní s aktivitou H3O+ a OH– iónov oveľa väčšia, je možné koncentráciu vody považovať za konštantnú a vyjadriť iónový súčin vody (Kw):
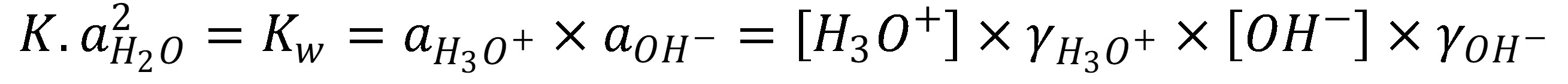 (3)
(3)
V zriedených roztokoch (menej ako 1×10-3 mol l-1) má koncentrácia a aktivita veľmi podobnú hodnotu z dôvodu, že aktivitné koeficienty sa blížia k jednotke, preto
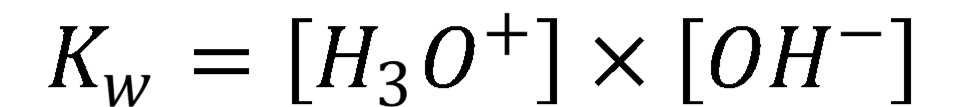 (4)
(4)
Iónový súčin vody je veličina závislá od teploty, pri 0 °C má hodnotu 0,11×10–14, pri 25 °C je to 1,01×10–14, pri 50 °C je to 5,47×10–14. Pokiaľ voda neobsahuje, žiadne látky, ktoré sú schopné H+ uvoľniť (kyseliny) alebo H+ prijať (zásady), koncentráciu H3O+ určuje autoprotolýza vody a platí, že . V tomto prípade koncentrácia H3O+ je daná odmocninou iónového súčinu vody pre aktuálnu teplotu, pri laboratórnej teplote to je cca. 1×10–7 mol l-1. Keďže koncentrácia H3O+ sa môže nachádzať vo veľmi širokom intervale, pre zjednodušenie vyjadrovania bola zavedená (Sørensen) pH stupnica. Absolútne čistá voda má pH rovnajúcu sa 7, pri laboratórnej teplote.
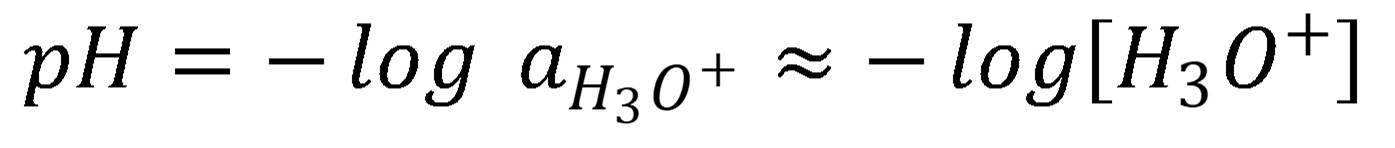 (5)
(5)
Podobne je možné definovať aj pOH:
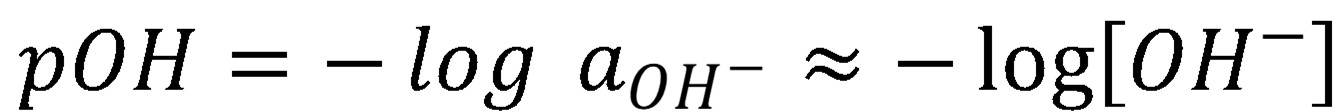 (6)
(6)
Tab. 1 Koncentrácie H3O+, OH– a hodnoty pH.
| [H3O+] | 10-2 | 10-3 |
10-4 |
10-5 |
10-6 |
10-7 |
10-8 |
10-9 |
10-10 |
1,08x10-11 |
1,24x10-12 |
|
pH |
2,05 |
3,02 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
10,98 |
11,95 |
|
[OH-] |
1,24x10-12 |
1,08x10-11 |
10-10 |
10-9 |
10-8 |
10-7 |
10-6 |
10-5 |
10-4 |
10-3 |
10-2 |
Koncentrácie sú vyjadrené v mol/l.
Pri známej hodnote aktivity H3O+ je možné vypočítať aktivitu OH– podľa vzorca (3), resp. pri známej hodnote pH je možné vypočítať pOH podľa nasledovného vzorca.
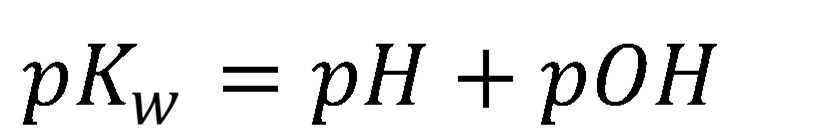 (7)
(7)
Prídavkom kyseliny pH klesá, prídavkom zásady pH narastá. Vplyv jednotlivých zlúčenín na pH roztoku závisí jednak od koncentrácie látky a jednak od acidobázických vlastností. Z tohto pohľadu je dôležité poznať vplyv silných a slabých kyselín, silných a slabých báz, kyslých, neutrálnych a zásaditých solí a pH tlmivých systémov na aktuálne pH roztokov.
Pre silné kyseliny a zásady je charakteristické, že prakticky pri všetkých koncentráciách je acidobázická rovnováha (8 a 10) úplne posunutá doprava. To znamená, že analytická (celková) koncentrácia priamo udáva koncentráciu H3O+ resp. OH–.
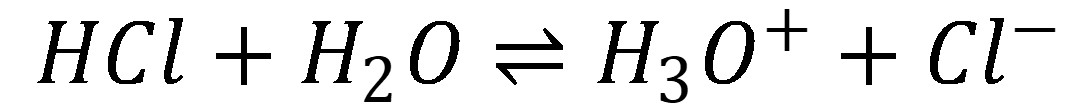 (8)
(8)
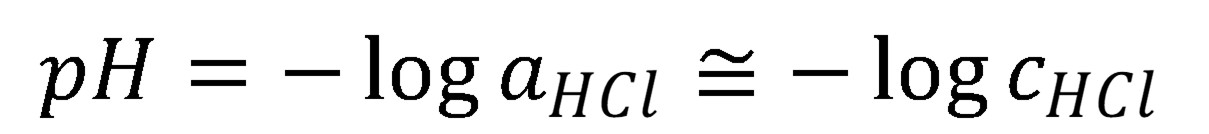 (9)
(9)
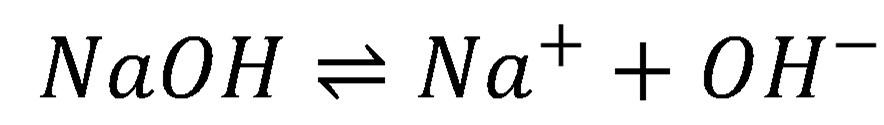 (10)
(10)
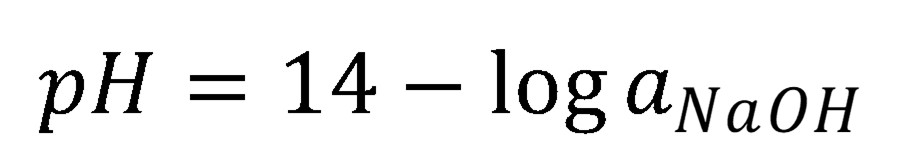 (11)
(11)
Slabé kyseliny sú disociované len čiastočne.
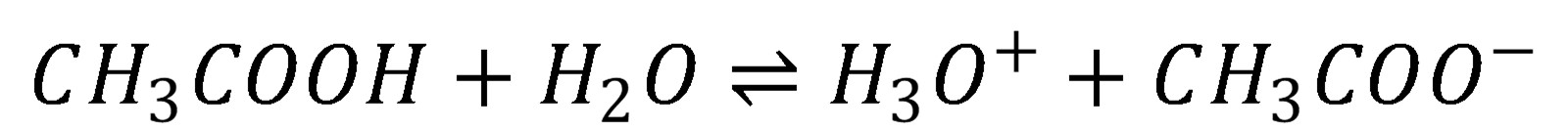 (12)
(12)
Mieru disociácie udáva disociačná konštanta (Ka) – konštanta kyslosti, v zriedených roztokoch má tvar:
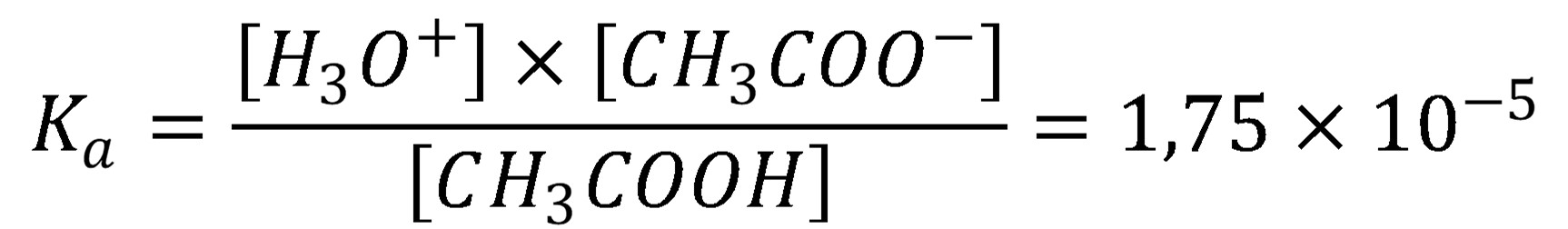 (13)
(13)
Ak je pomer koncentrácie kyseliny a disociačnej konštanty väčší ako 100, je možné predpokladať, že a a rovnica (13) sa zmení
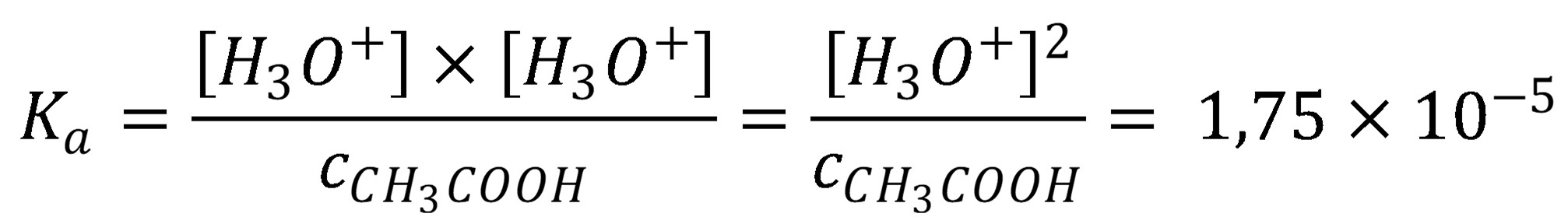 (14)
(14)
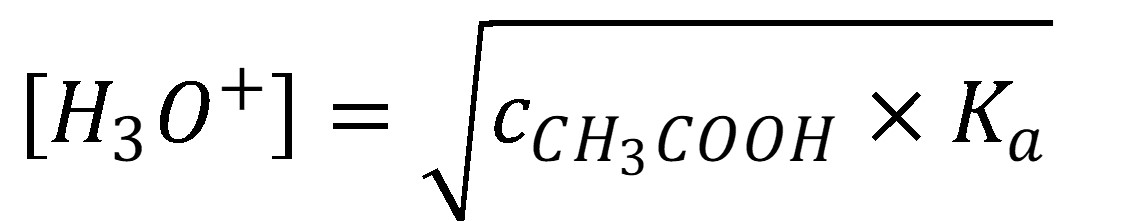 (15)
(15)
V opačnom smere, teda v smere asociácie je to protonizačná konštanta (Kb).
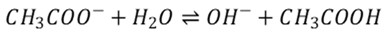 (16)
(16)
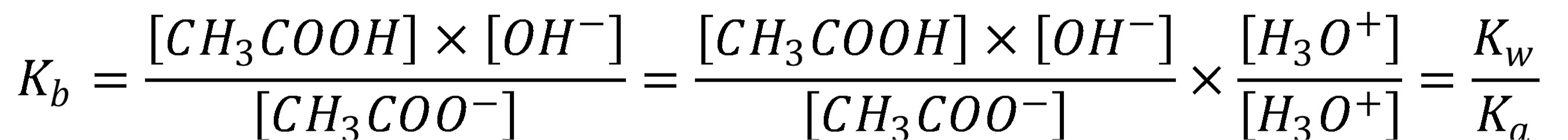 (17)
(17)
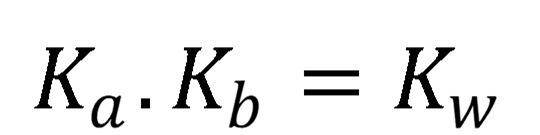 (18)
(18)
Slabé zásady (napr. amoniak) sú protonizované len čiastočne. Tabuľková hodnota disociačnej konštanty pre amóniový katión je Ka = 5,7 10–10.
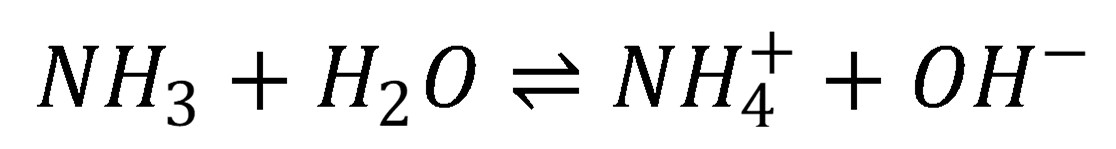 (19)
(19)
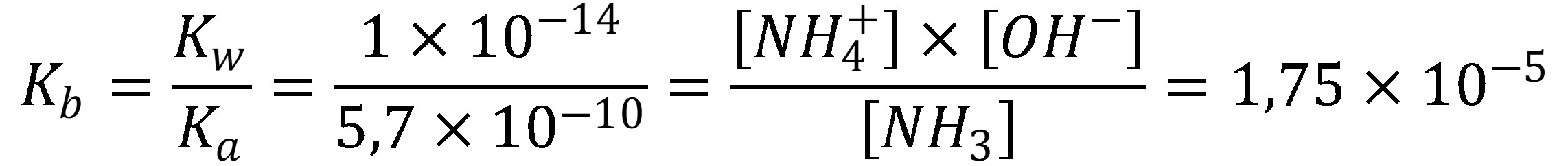 (20)
(20)
Ak je pomer koncentrácie bázy a protonizačnej konštanty väčší ako 100, je možné predpokladať, že a a a rovnica (20) sa zmení
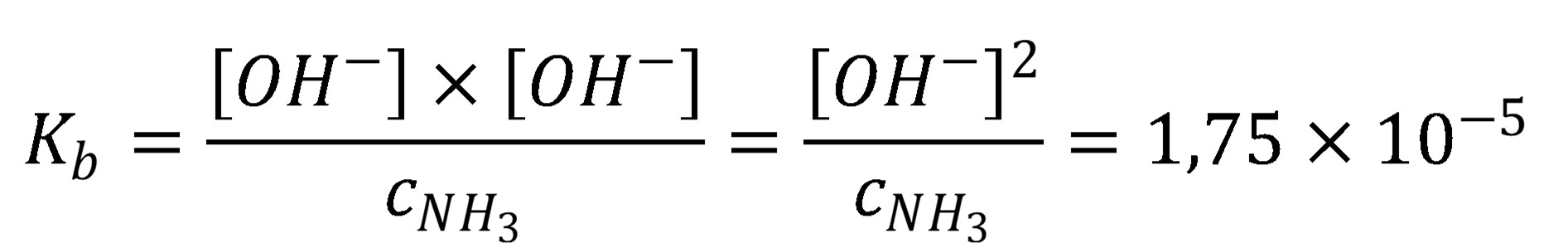 (21)
(21)
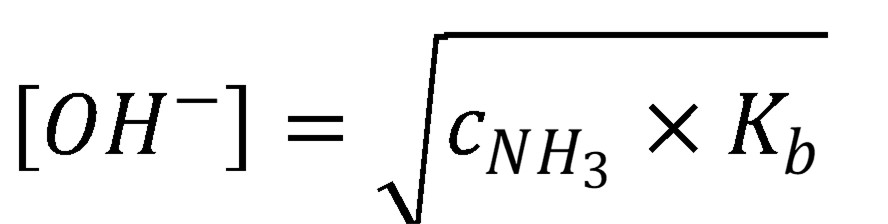 (22)
(22)
Dosadením rovnice (22) do rovnice (4) dostaneme koncentráciu H3O+ v roztoku slabej bázy.
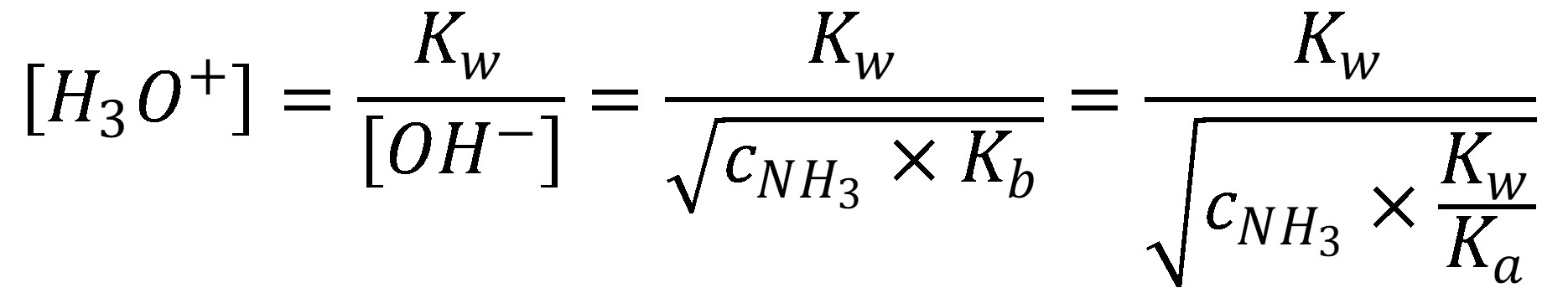 (23)
(23)
Medzi zásadité soli patria tie, ktoré sú tvorené aniónom slabej kyseliny a katiónom silnej zásady, napr. octan sodný. Po ich rozpustení vo vode je pH roztoku spravidla vyššie ako pH čistej vody, kvôli hydrolýze aniónu pri ktorom vznikne OH– a nedisociovaná kyselina (16).
Pokiaľ je koncentrácia soli väčšia a 100 násobok Kb je možné v rovnici (17) nahradiť koncentráciou soli (cs) a následne z dôvodu rovnosti aj za .
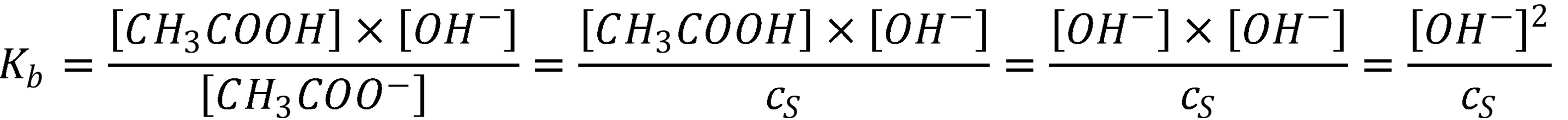 (24)
(24)
Podobne, ako pri slabých bázach vieme vyjadriť koncentráciu H3O+ v roztoku zásaditej soli.
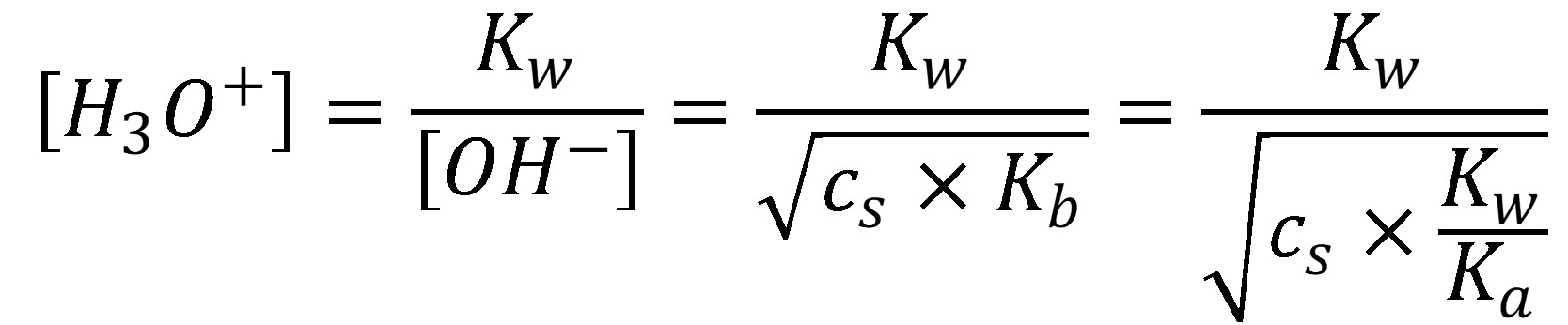 (25)
(25)
Katióny slabých báz podliehajú tiež hydrolýze, pri ktorej sa do roztoku uvoľňuje H+, preto pH roztoku soli slabej bázy s aniónom silnej kyseliny (napr. NH4Cl alebo TRIS.HCl) je kyslé.
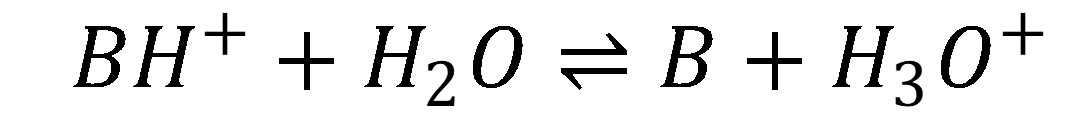 (26)
(26)
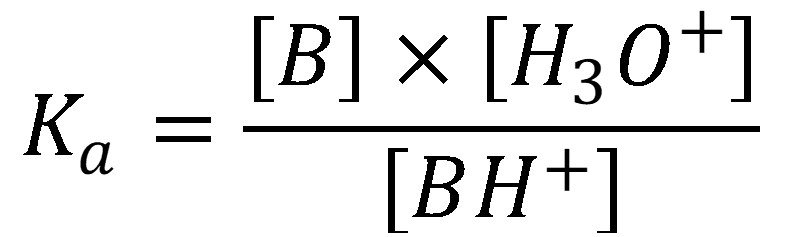 (27)
(27)
Pokiaľ je koncentrácia soli väčšia ako 100 násobok Ka je možné nahradiť v rovnici (27) [BH+] za cs a [B] za [H3O+].
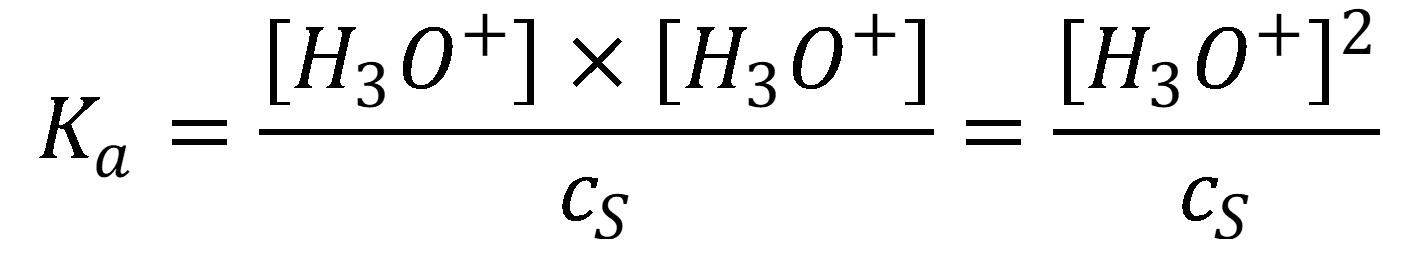 (28)
(28)
Tlmivé roztoky sú roztoky, ktoré dokážu eliminovať zmenu pH po prídavku malého množstva kyseliny alebo zásady. Obvykle tlmivé roztoky obsahujú slabú kyselinu a jej soľ alebo slabú bázu a jej soľ. V prípade kyseliny octovej (slabá kyselina) a octanu sodného (soľ) je možné upraviť rovnicu (13) na:
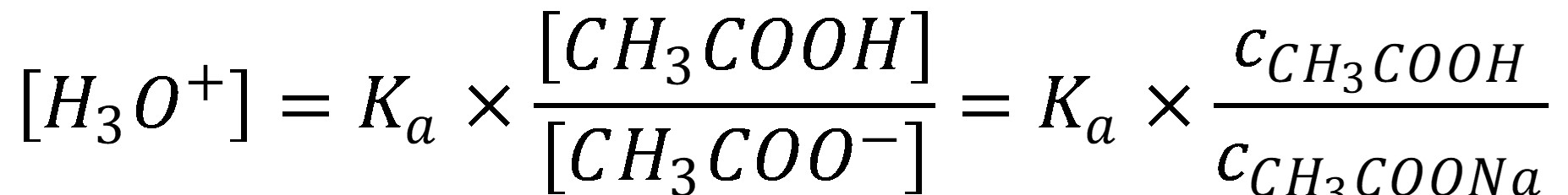 (29)
(29)
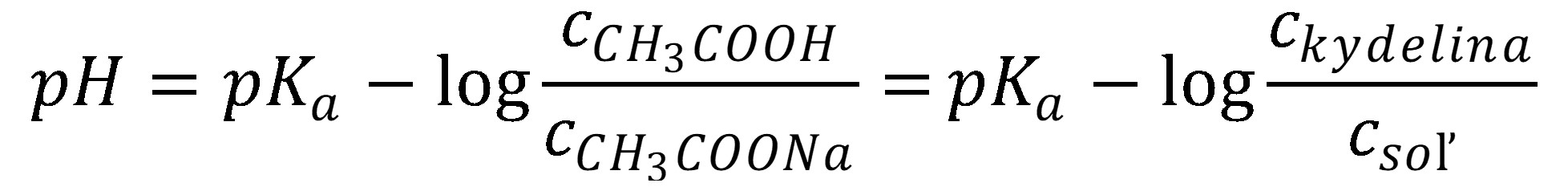 (30)
(30)
Tlmivý roztok kyseliny octovej – octanu sodného, okrem zmiešania kyseliny a soli, je možné pripraviť aj zmiešaním kyseliny octovej a hydroxidu sodného alebo zmiešaním octanu sodného so silnou kyselinou (napr. HCl). Pridaním NaOH do kyseliny octovej, ekvivalentná časť kyseliny octovej sa zmení na octan, preto a . Pridaním HCl do roztoku octanu sodného, ekvivalentná časť octanu sa zmení na kyselinu octovú, preto a .
V prípade tlmivého roztoku amoniaku (slabá báza) a chloridu amónneho (soľ) je možné upraviť rovnicu (27).
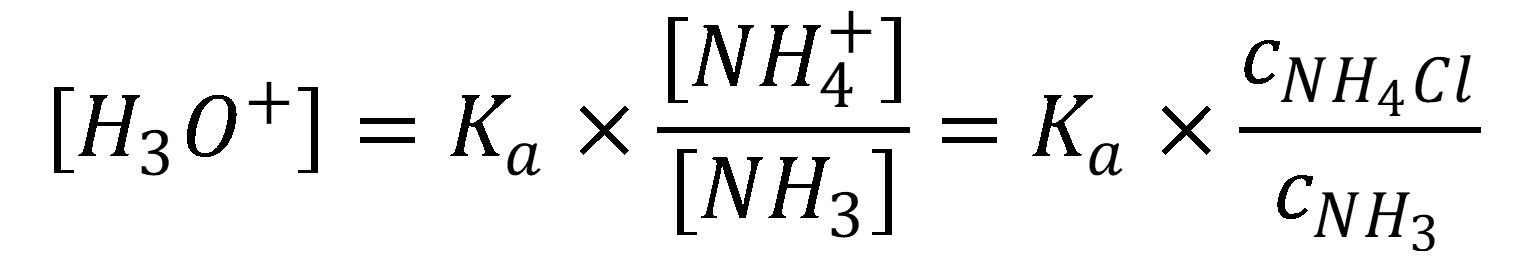 (31)
(31)
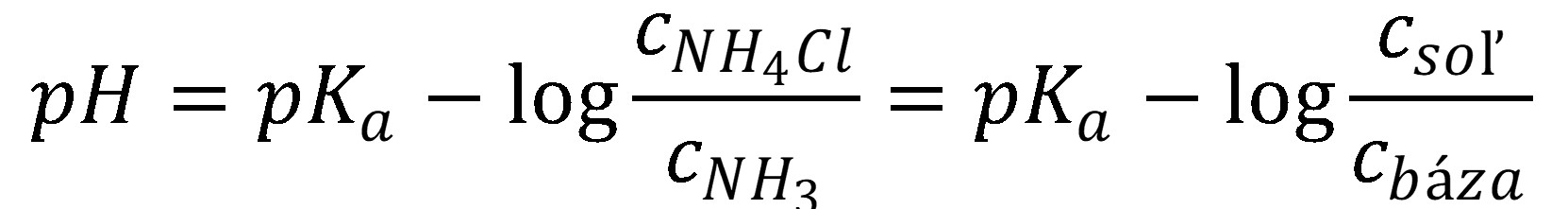 (32)
(32)
Príprava tlmivého roztoku, ktorý obsahuje slabú bázu a jej soľ je možné taktiež tromi spôsobmi. 1) zmiešaním samotnej bázy a soli, 2) zmiešaním bázy a silnej kyseliny (napr. HCl), ktorá časť bázy zmení na soľ a 3) zmiešaním soli a silnej zásady, ktorá časť soli zmení na bázu. Pri postupe č. 2 bude platiť, že a . Pri postupe č.3 bude platiť, že a .
Tlmiaca schopnosť tlmivých roztokov spočíva v tom, že po prídavku kyseliny alebo zásady sa nemení priamo koncentrácia H3O+, ale len pomer disociovanej a nedisociovanej formy tlmivého systému. Množstvo prídavku kyseliny alebo zásady bez významnej zmeny pH tlmivého roztoku závisí tak od koncentrácie kyseliny a soli tvoriaci tlmivý systém, ako aj od ich pomeru. Tento parameter tlmivého roztoku sa nazýva tlmiaca kapacita. Najväčšia tlmivá kapacita je vtedy, ak je pomer soli a kyseliny, resp. soli a bázy jednotkový, teda ak pH tlmivého roztoku sa rovná pKa.
Za určitých podmienok, najmä ak charakter rozpustených látok (napr. neutrálne soli) alebo koncentrácia látok vyvolá v koncentrácií H3O+ voči čistej vode len malé zmeny, môže mať veľký vplyv na výsledné pH roztoku CO2 absorbovaný zo vzduchu do vody použitej pri príprave roztoku. Podľa rovnováhy (33) je možné odhadnúť pH čistej vody, ak vieme koncentráciu kyseliny uhličitej, resp. pomocou experimentálne zistenej hodnoty pH odhadnúť koncentráciu kyseliny uhličitej (34), viď tabuľku 2.
Tab. 2 pH vody v závislosti od koncentrácie H2CO3
|
c(H2CO3) (mol l-1) |
pH vody |
|
1x10-6 |
6,3 |
|
5x10-6 |
5,9 |
|
1x10-5 |
5,7 |
|
2,5x10-5 |
5,5 |
|
6x10-5 |
5,3 |
|
1x10-4 |
5,2 |
Podľa Henryho zákona, ak vzduch obsahuje 387 ppm CO2, rovnovážna koncentrácia vo vode bude 1,3×10–5 mol l-1.
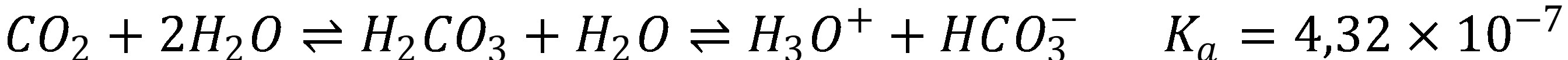 (33)
(33)
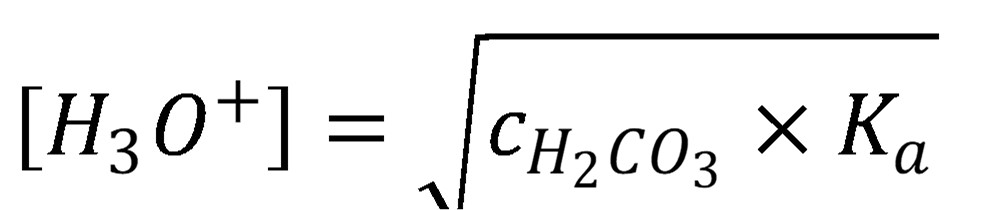 (34)
(34)
Živé organizmy sú založené na báze vody, čo znamená, že do veľkej miery závisia od rôznych rovnováh, najmä od acidobázickej rovnováhy. Dôvody, prečo je dôležité zaujímať sa o pH v biologických systémoch: (1) súvisí s mnohými problémami v bunkovej biológii, (2) funkčné skupiny schopné prijať alebo odovzdať protón sa nachádzajú v makromolekulách (napr. bielkoviny), ako aj v malých molekulách (napr. aminokyseliny, amíny, karboxylové kyseliny), (3) prostredie bunky je vždy pufrované (tlmené) tlmivým roztokom na pH približne 7, (4) rôzne experimenty (napr. enzymatické testy, kultivácie buniek) vyžadujú určité pH, (5) pH vody určuje rozpustnosť (množstvo, ktoré sa môže rozpustiť vo vode) a biologickú dostupnosť (množstvo, ktoré môže vodný život využiť) chemických zložiek, napr. živín (fosfor, dusík a uhlík).
Pri súčasných možnostiach výpočtovej techniky existuje množstvo zdrojov, ktoré pomáhajú pri riešení rôznych úloh súvisiacich s chémiou. V oblasti acidobázických rovnováh takou pomôckou je súbor pre program MS Excel voľne dostupná na stránke http://www.iq.usp.br/gutz/Curtipot_.html.
V praxi sa najčastejšie používajú dve metódy stanovenia pH roztokov: (1) semikvantitatívne (približné) stanovenie pomocou indikátorov a (2) rovnovážna potenciometria pomocou sklenej elektródy. Indikátory pH sú slabé kyseliny, ktoré majú v disociovanom stave (po odovzdaní protónu) inú farbu, ako v nedisociovanom stave. Môžu sa použiť vo forme roztoku alebo napustené v papierovom prúžku. Kvapalná forma indikátorov pH sa zvyčajne pridáva priamo do roztokov, papierová forma sa na len krátku chvíľu ponorí do roztoku vzorky alebo pomocou pomôcky (napr. sklenej tyčinky, pipety) kvapne 1-2 kvapiek vzorky na papierik. Hodnota pH sa určuje vizuálne porovnaním farby vzorky resp. papierového prúžku s tabuľkou farba/pH. Univerzálne indikátorové papieriky sú impregnované zmesou viacerých indikátorov.
Rovnovážna potenciometria je elektroanalytická metóda, ktorá využíva fakt, že potenciál niektorých indikačných elektród je logaritmickou funkciou aktivity príslušného iónu alebo pomeru aktivít oxidovanej a redukovanej formy konkrétnej látky a to v závislosti od typu použitej indikačnej elektródy. Tento potenciál sa dá vyjadriť pomocou Nerstovej rovnice. Na priame stanovenie koncentrácie látky sa takmer výlučne používajú ión selektívne indikačné elektródy (ISE). Charakteristickou vlastnosťou ISE je, že jej potenciál závisí prakticky len od aktivity konkrétneho iónu. V skutočnosti, potenciál ISE ovplyvňujú aj iné ióny (interferenty) ale v oveľa menšej miere ako ión, pre ktorý je ISE skonštruovaná.
Priame stanovenie koncentrácie H3O+ rovnovážnou potenciometriou, je založené na meraní rovnovážneho potenciálu cely zloženého zo sklenej (ISE) a argentochloridovej (referenčná) elektródy v bezprúdovom stave. Vyžaduje to špeciálne meracie zariadenie s veľkým vnútorným odporom.
Najdôležitejšia časť sklenej elektródy je sklená membrána zo špeciálneho skla o hrúbke približne 50 µm, ktorá je hydratovaná na oboch stranách v hrúbke niekoľko desiatok nm. Pre potenciál sklenej elektródy platí:
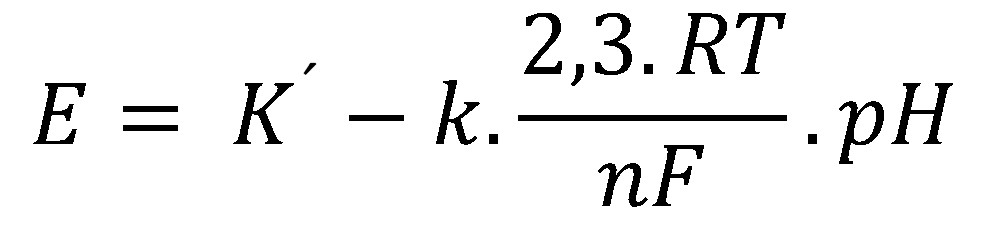 (35)
(35)
Stanovenie K´ (úsek) a k (korekčný faktor teoretickej smernice) je predmetom kalibrácie, čiže merania potenciálu aspoň dvoch roztokov so známymi hodnotami pH. Moderné prístroje dokážu sami rozpoznať zo zadaného zoznamu roztokov ten, do ktorého je elektróda ponorená a taktiež po dokončení kalibrácie zobrazovať priamo hodnoty pH. Teda, potenciál nameraný v neznámych vzorkách je pomocou zistených kalibračných parametrov v zariadení prepočítaný na pH.
Experimentálna časť
Ciele:
1. Zoznámiť sa princípmi stanovenia pH roztokov indikátorovým papierikom a rovnovážnou potenciometriou.
2. Experimentálne zistiť vplyv koncentrácie rôznych elektrolytov (silné kyseliny, slabé zásady, soli) na pH roztoku.
3. Získať experimentálne skúsenosti s prípravou tlmivých roztokov a tlmiacou kapacitou.
Úlohy
1. Kalibrovať pH meter podľa návodu na obsluhu.
2. Stanoviť pH vzoriek (napr. džús, minerálna voda, kaputová šťava, …) indikátorovým papierikom a rovnovážnou potenciometriou.
3. Pripraviť roztoky HCl s koncentráciami 1×10-2 a 1×10-4 mol l-1, stanoviť ich pH a zistiť vplyv prídavku HCl na pH.
4. Pripraviť roztoky KCl s koncentráciami 1×10-2, a 1×10-4 mol l-1, stanoviť ich pH a zistiť vplyv prídavku HCl na pH.
5. Pripraviť roztok octanu sodného (NaAc) s koncentráciou 1×10-2, stanoviť jeho pH a zistiť vplyv prídavku HCl na pH.
6. Pripraviť roztoky TRIS s koncentráciami 1×10-2 a 1×10-4 mol l-1, stanoviť ich pH a zistiť vplyv prídavku HCl na pH.
7. Pripraviť roztok zmesi HCl a NaAc, kde koncentrácia HCl bude 5×10-3 mol l-1 a NaAc 1×10-2 mol l-1, stanoviť jeho pH a zistiť vplyv prídavku HCl na pH.
8. Pripraviť roztok zmesi HCl a NaAc, kde koncentrácia HCl bude 5×10-4 mol l-1 a NaAc 1×10-3 mol l-1, stanoviť jeho pH a zistiť vplyv prídavku HCl na pH.
10. Pripraviť roztok zmesi HCl a TRIS, kde koncentrácia HCl bude 5×10-3 mol l-1 a TRIS 1×10-2 mol l-1, stanoviť jeho pH a zistiť vplyv prídavku HCl na pH.
11. Pripraviť roztok zmesi HCl a TRIS, kde koncentrácia HCl bude 5×10-4 mol l-1 a TRIS 1×10-3 mol l-1, stanoviť jeho pH a zistiť vplyv prídavku HCl na pH.
Postup
- Na kalibráciu pH metra použite kalibračné štandardy s pH = 4 a pH = 7 a postupujte podľa návodu k prístroju.
- Zmerajte pH dostupných vzoriek pomocou pH papierika a podľa návodu k pH metru a zapíšte do tabuľky 3.
Tab. 3 Stanovené hodnoty pH vzoriek
|
Vzorka |
pH (papierik) |
pH (prístroj) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Do 50 ml odmernej banky napipetujte vypočítaný objem príslušného zásobného roztoku s koncentráciou 0,1 mol l-1 (napr. z 0,1 mol l-1 HCl, z 0,1 mol l-1 KCl, z 0,1 mol l-1 NaAc alebo z 0,1 mol l-1 TRIS) a doplňte deionizovanou vodou po značku. Potrebný objem vypočítajte pred cvičením pomocou vzorca (36) a zapíšte do tabuľky 4. V úlohách (7 – 10), v ktorých pripravujete zmes roztokov, do 50 ml odmernej banky pipetujte vypočítané objemy z oboch zásobných roztokov a doplňte deionizovanou vodou po značku.
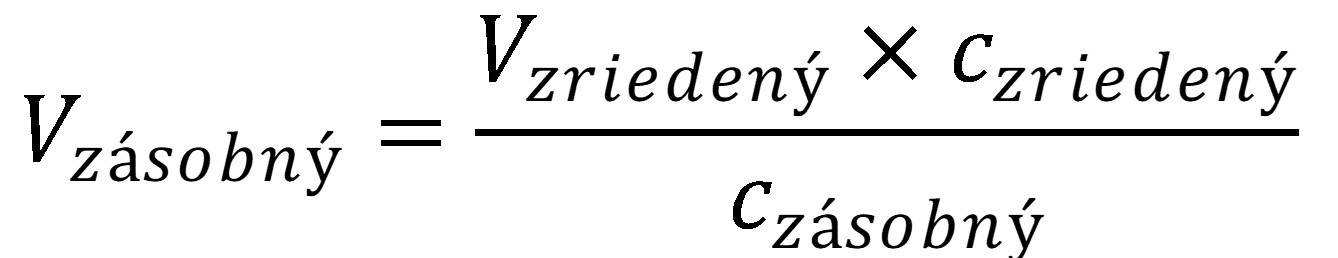 (36)
(36)
Tab. 4 Príprava roztokov
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
pH pripravených roztokov stanovte rovnovážnou potenciometriou. Meranie pH môže prebiehať priebežne s prípravou roztokov.
1) Na stanovenie pH odmerajte 25 ml roztoku odmerným valcom a prelejte do nádobky na meranie pH. Do roztoku ponorte kombinovanú sklenú elektródu a samotné meranie uskutočnite podľa návodu k pH metru. Výsledok zapíšte do tabuľky 5.
2) Vyberte elektródu z meracej nádobky, pridajte do roztoku v meracej nádobke 50 μl (0,05 ml) zásobného roztoku HCl s koncentráciou 0,1 mol l-1, čím navýšite koncentráciu HCl v roztoku o 2×10-4 mol l-1 (vzorec 37).
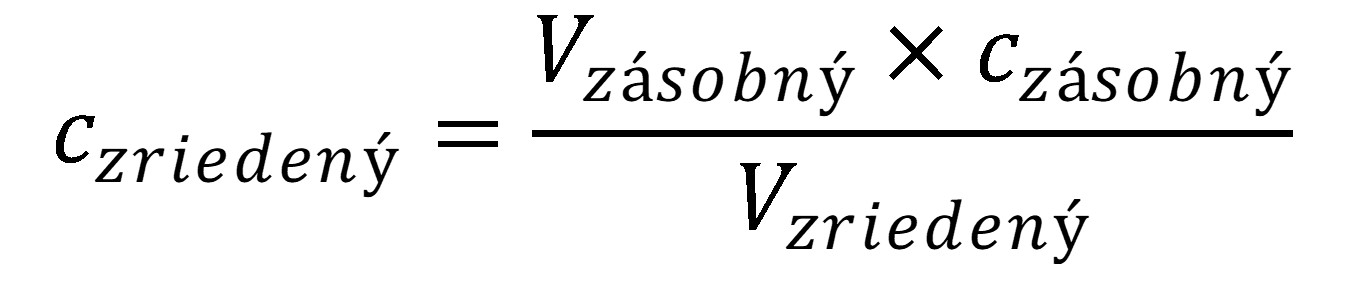 (37)
(37)
Zmiešajte roztok sklenou tyčinkou, ponorte elektródu do roztoku a znova zmerajte pH. Výsledok zapíšte do tabuľky 5.
3) Vyberte elektródu z meracej nádobky a opláchnite deionizovanou vodou. Vypláchnite meraciu nádobku pod tečúcou vodovodnou vodou a následne aj deionizovanou vodou. Opláchnite sklenú tyčinku pod tečúcou vodovodnou vodou a následne aj deionizovanou vodou. Vypláchnite odmerný valec pod tečúcou vodovodnou vodou a následne aj deionizovanou vodou.
4) Opakujte body 1-3 s ďalšími roztokmi.
Teoretické pH uvedené v tabuľke 5 vypočítajte pomocou vzorcov:
i. roztoky 3a, 3b – vzorec (9)
ii. roztok 5 – vzorec (25) a (5)
iii. roztoky 6a, 6b – vzorec (23) a (5)
iv. roztoky 7, 8 – vzorec (30)
v. roztok 9, 10 – vzorec (32)
Ka(CH3COOH)=1,75×10-5, pKa(CH3COOH)=4,76
Ka(TRIS)=8,41×10-9, pKa(TRIS)=8,08
Tab. 5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
- delta pH = pH (po prídavku HCl) - pH (stanovené)
Návod na obsluhu pH metra PASCO
Bezdrôtový pH meter slúži na stanovenie pH roztokov. Samotný pH meter sa skladá zo sklenej kombinovanej elektródy a senzora spojenej s elektródou BNC konektorom- Senzor komunikuje s obslužným programom SPARKvue bezdrôtovo cez rozhranie Bluetooth. Program SPARKvue je voľne dostupný v AppStore a v GooglePlay.

Bezdrôtový pH meter Pasco
Súbor na stiahnutie
Návod pH meter PascoMetodika pre učiteľa
Výskumná otázka
Teoretický základ
Každý vodný roztok obsahuje H+ ióny, ktoré sa nevyskytujú vo voľnej forme, ale v roztoku sa nachádzajú v hydratovanej forme (najmä H3O+ - oxóniový katión). V závislosti od koncentrácie a typu rozpustených zlúčenín, koncentrácia H3O+ vo vodných roztokoch sa môže meniť vo veľmi širokom intervale (1 až 1×10-14 mol l-1). Samotná voda podlieha autoprotolýze podľa rovnice:
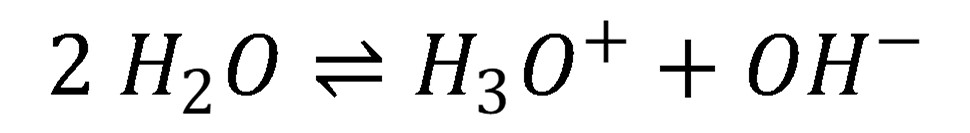
Pre túto rovnicu platí rovnovážna konštanta:
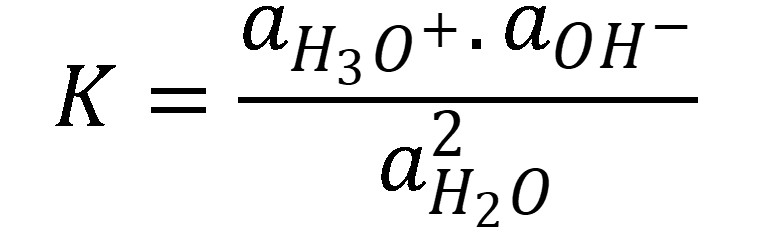
Iónový súčin vody je veličina závislá od teploty, pri 0 °C má hodnotu 0,11×10–14, pri 25 °C je to 1,01×10–14, pri 50 °C je to 5,47×10–14. Pokiaľ voda neobsahuje, žiadne látky, ktoré sú schopné H+ uvoľniť (kyseliny) alebo H+ prijať (zásady), koncentráciu H3O+ určuje autoprotolýza vody a platí, že . V tomto prípade koncentrácia H3O+ je daná odmocninou iónového súčinu vody pre aktuálnu teplotu, pri laboratórnej teplote to je cca. 1×10–7 mol l-1. Keďže koncentrácia H3O+ sa môže nachádzať vo veľmi širokom intervale, pre zjednodušenie vyjadrovania bola zavedená (Sørensen) pH stupnica. Absolútne čistá voda má pH rovnajúcu sa 7, pri laboratórnej teplote.
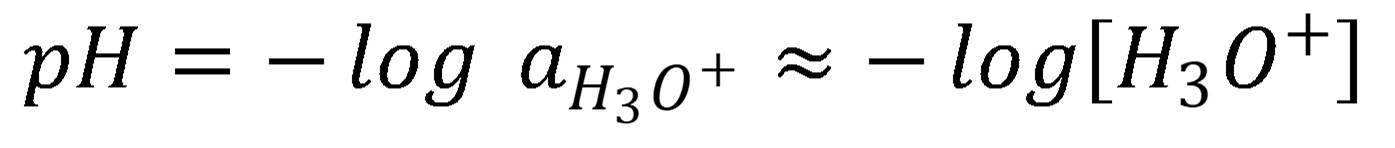
Podobne je možné definovať aj pOH:
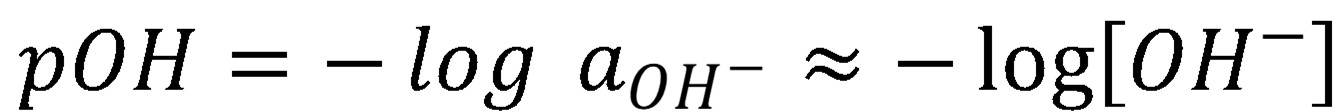
Tabuľka 1 Koncentrácie H3O+, OH– a hodnoty pH
|
[H3O+] |
10-2 |
10-3 |
10-4 |
10-5 |
10-6 |
10-7 |
10-8 |
10-9 |
10-10 |
1,08x10-11 |
1,24x10-12 |
|
pH |
2,05 |
3,02 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
10,98 |
11,95 |
|
[OH-] |
1,24x10-12 |
1,08x10-11 |
10-10 |
10-9 |
10-8 |
10-7 |
10-6 |
10-5 |
10-4 |
10-3 |
10-2 |
Koncentrácie sú vyjadrené v mol/l.
Pri známej hodnote aktivity H3O+ je možné vypočítať aktivitu OH– resp. pri známej hodnote pH je možné vypočítať pOH podľa nasledovného vzorca.
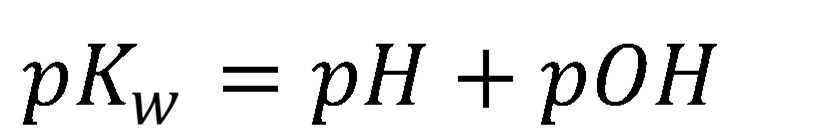
V praxi sa najčastejšie používajú dve metódy stanovenia pH roztokov: (1) semikvantitatívne (približné) stanovenie pomocou indikátorov a (2) rovnovážna potenciometria pomocou sklenej elektródy. Indikátory pH sú slabé kyseliny, ktoré majú v disociovanom stave (po odovzdaní protónu) inú farbu, ako v nedisociovanom stave. Môžu sa použiť vo forme roztoku alebo napustené v papierovom prúžku. Kvapalná forma indikátorov pH sa zvyčajne pridáva priamo do roztokov, papierová forma sa na len krátku chvíľu ponorí do roztoku vzorky alebo pomocou pomôcky (napr. sklenej tyčinky, pipety) kvapne 1-2 kvapiek vzorky na papierik. Hodnota pH sa určuje vizuálne porovnaním farby vzorky resp. papierového prúžku s tabuľkou farba/pH. Univerzálne indikátorové papieriky sú impregnované zmesou viacerých indikátorov.
Rovnovážna potenciometria je elektroanalytická metóda, ktorá využíva fakt, že potenciál niektorých indikačných elektród je logaritmickou funkciou aktivity príslušného iónu alebo pomeru aktivít oxidovanej a redukovanej formy konkrétnej látky a to v závislosti od typu použitej indikačnej elektródy. Tento potenciál sa dá vyjadriť pomocou Nerstovej rovnice. Na priame stanovenie koncentrácie látky sa takmer výlučne používajú ión selektívne indikačné elektródy (ISE). Charakteristickou vlastnosťou ISE je, že jej potenciál závisí prakticky len od aktivity konkrétneho iónu. V skutočnosti, potenciál ISE ovplyvňujú aj iné ióny (interferenty) ale v oveľa menšej miere ako ión, pre ktorý je ISE skonštruovaná.
Priame stanovenie koncentrácie H3O+ rovnovážnou potenciometriou, je založené na meraní rovnovážneho potenciálu cely zloženého zo sklenej (ISE) a argentochloridovej (referenčná) elektródy v bezprúdovom stave. Vyžaduje to špeciálne meracie zariadenie s veľkým vnútorným odporom.
Najdôležitejšia časť sklenej elektródy je sklená membrána zo špeciálneho skla o hrúbke približne 50 µm, ktorá je hydratovaná na oboch stranách v hrúbke niekoľko desiatok nm. Pre potenciál sklenej elektródy platí:
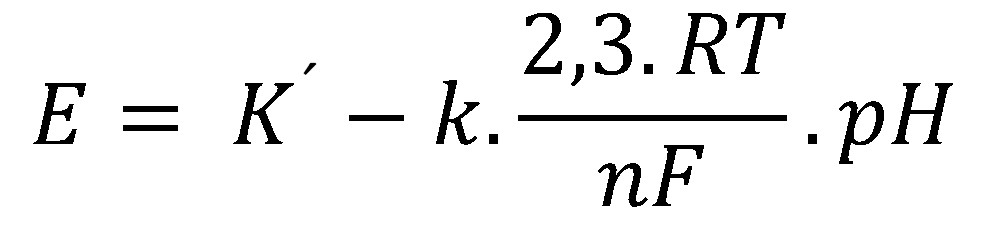
Inovatívna a tvorivá práca študenta
Cieľom laboratórneho cvičenia je rozvíjať u študentov budúcich učiteľov vedomosti a potrebné kompetencie na implementáciu STEM stratégie do vzdelávania na školách na Slovensku.
Živé organizmy sú založené na báze vody, čo znamená, že do veľkej miery závisia od rôznych rovnováh, najmä od acidobázickej rovnováhy. Učiteľ a jeho žiaci/študenti by mali poznávať prečo je dôležité zaujímať sa o pH v biologických systémoch. Pre človeka je dôležité poznať pH svojich ľudských tekutín, poznať pH roztokov, s ktorými prichádza do styku, poznať pH vody, pôdy atď. Určovanie acidobázickej rovnováhy v systémoch je veľmi dôležité pre náš ekologický systém, pre našu výživu, pre zdravie a i.
Úloha 1. (práca pre dvojice študentov)
- Zrealizujte STEM experiment s názvom: Prečo niektoré kvety menia farbu?
- Navrhnite postup realizácie STEM experimentu na dvoch úrovniach? Pre žiakov ZŠ a SŠ. Pre vytvorenie metodiky STEM experimentu použi digitálne prostredie SPARKvue.
- Bude to multidisciplinárny experiment? Ak áno, tak uveď ktoré predmety budete integrovať?
Úloha 2. (práca pre dvojice študentov)
Spracujte pre žiakov časový priebeh experimentu, nakoľko sa jedná o projekt s väčšou dĺžkou realizácie.
Úloha 3.
- Navrhnite dva ďalšie námety STEM experimentov na meranie pH vorných roztokov tak aby ste použili oba spôsoby merania pH: semikvantitatívne (približné) stanovenie pomocou indikátorov (pH papierika) a metódou rovnovážnej potenciometrie pomocou sklenej pH elektródy (pH senzor).
 STEM
STEM