Skúmanie farebnosti prírodných látok
Oblasť skúmania
Prírodné farbivá v rastlinách
Prírodné farbivá sú prirodzenou súčasťou prírody okolo nás. V zložitom systéme vzťahov medzi biologickými objektami majú veľa a častokrát aj zvláštnych úloh. Chlorofyly, karotenoidy, xantogény sú súčasťou systémov zachytávajúcich energiu fotónov vo fotosyntetických aparátoch rastlín. Podobnú funkciu v energetickom systéme živočíchov ale zameranú na transport kyslíka v majú hemoglobín a iné krvné farebné látky.
Betanín, je červené glykozidové potravinárske farbivo získavané z červenej repy (Beta vulgaris). Aglykón betanínu získaný hydrolýzou a oddelením molekuly glukózy sa nazýva betanidín a ako potravinárske farbivo má značku E162.

Obr. 1: Červená repa
Betanín sa obyčajne získava z extraktov šťavy červenej repy. Koncentrácia betanínu v červenej repe sa pohybuje v rozmedzí 300–600 mg kg-1. Okrem uvedeného zdroja sa nachádza spolu so sprievodnými betalanínmi aj v plodoch – kaktusových figách opuncií (Opuntia ficus-indica), v kvetoch, plodoch a listoch stromov amarant (napríklad Amaranthus caudatus) a mnohých iných zo 44 zástupcov tohto druhu.
Betanín sa používa hlavne na dofarbovanie mrazených potravín, potravín predávaných v suchom stave a tiež potravín, ktoré majú definovanú krátku dobu od výroby do spotreby. Používa sa tiež na dofarbovanie mäsa a párkov, zmrzlín, cukríkov, krémov, ovocných drení a náplní, paradajkových pretlakov polievok a mnohých iných potravín. Betanín sa neznehodnocuje ani pasteurizáciou, napriek pôsobeniu vysokých teplôt, pokiaľ je v prostredí s vysokým obsahom cukrov. Avšak pri výrobe za vysokej teploty extrudovaných cukríkov sa pridáva až v konečnej fáze ich výroby. Betanín sa v črevách dobre absorbuje a priaznivo pôsobí ako antioxidant. Po jeho konzumácii môžeme pozorovať jeho prítomnosť v moči a stolici na základe ich charakteristického sfarbenia. Betanín nemá prakticky žiadne alergizujúce účinky na organizmus.
Betanín degraduje – chemická štruktúra betanínu sa mení pôsobením svetla, pri zohrievaní a vplyvom vzdušného kyslíka. Jeho citlivosť na oxidáciu kyslíkom je najväčšia pri potravinách s vysokým obsahom vody a v prítomnosti niektorých katiónov kovov (napr., železa a medi). Tento proces tiež spomaľujú antioxidanty, napríklad kyselina askorbová. Betanín je v suchom stave odolný aj voči pôsobeniu vzdušného kyslíka. Uvedené skutočnosti jasne poukazujú na potrebu analýzy betanínu v rôznych vzorkách a v rôznorodých súvislostiach.
Sfarbenie roztokov betanínu závisí od pH. Pri hodnotách pH v rozmedzí 4.0 až 5.0 je roztok betanínu jasne modročervený, a pri zvyšovaní hodnoty pH sa stáva modrofialovým. Pri ďalšom zvyšovaní pH do alkalickej oblasti betanín začína hydrolyticky degradovať čo má za následok zmenu sfarbenia roztoku na žltú farbu a ďalej na hnedú farbu.
Betanín, 4-(2-(2-karboxy-5-(beta-D-glukopyranozyloxy)-2,3-dihydro-6-hydroxy-1H-indol-1-yl)etenyl)-2,3-dihydro-(S-(R*,R*))-2,6-pyridíndikarboxylová kyselina, je betalainové farbivo a v červenej repe sa okrem neho nachádzajú v menšom zastúpení aj izobetanín, probetanín, neobetanín, a farbivá s odlišnou chemickou štruktúrou indicaxantín a vulgaxantíny.
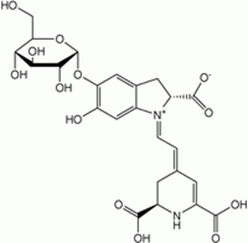
Obr. 2: Chemická štruktúra betanínu
Teoretická časť
Na meranie farebnosti chemických látok môžeme využiť ich schopnosť selektívne absorbovať elektromagnetické žiarenie vo viditeľnej oblasti spektra. Na obrázku 3 je znázornené celé spektrum elektromagnetického žiarenia a zvýraznená oblasť vo viditeľnej časti spektra (VIS).
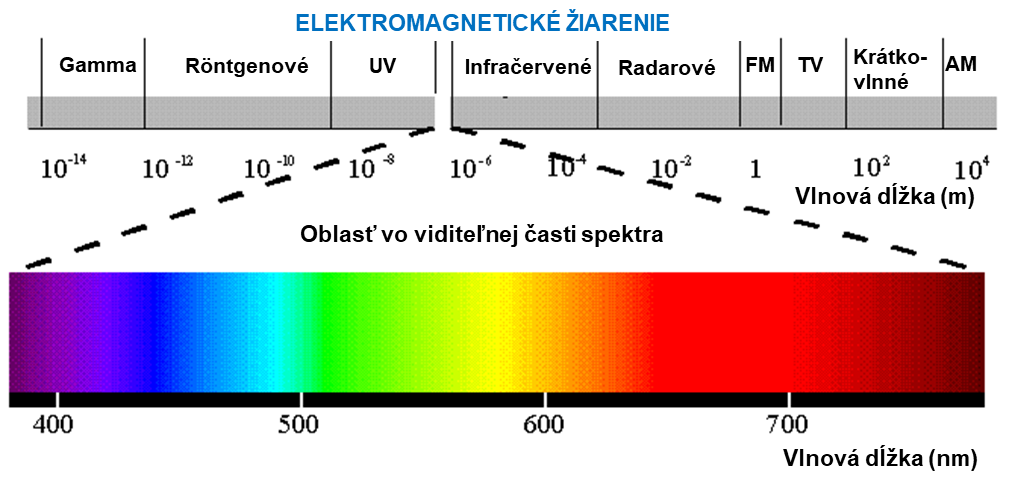
Obr. 3. Spektrum elektromagnetického žiarenia
SPEKTROFOTOMETRIA
Spektrofotometria sa zaoberá meraním a vyhodnocovaním elektrónových absorpčných spektier molekúl látok, ktoré absorbujú elektromagnetické žiarenie v rozsahu vlnových dĺžok 380 až 780 nm. Pri absorpcii VIS svetla dochádza v molekulách látok k excitácii vonkajších (väzbových) elektrónov a ľudskému oku sa javia ako farebné látky.
ELEKTRÓNOVÉ ABSORPČNÉ SPEKTRÁ
Elektrónové absorpčné spektrá zahŕňajú oblasť vlnovej dĺžky žiarenia v rozsahu od 50 do 1000 nm, najmä však v ultrafialovej a viditeľnej (UV-VIS)oblasti. V UV-VIS oblasti elektrónových spektier sa pracuje so žiarením takej energetickej hodnoty (DE ≈ 150 – 600 kJ mol-1), ktorá má schopnosť premiestňovať vonkajšie (valenčné) elektróny v molekule. Preskok elektrónov nastáva z energeticky chudobnejších molekulových orbitálov na orbitály energeticky bohatšie. Zotrvanie elektrónov v energeticky bohatšom stave je krátke (10-9 s) a pri prechode do základného stavu elektrón môže prechádzať rôznymi deexcitačnými prechodmi (nežiarivými aj žiarivými). Súčasne nastáva aj excitácia vibračných a rotačných stavov molekuly. Zmena celkovej energie molekuly DEM potom zahŕňa zmeny energie elektrónov DEe, zmeny vibračnej energie DEv a zmeny rotačnej energie DEr:
DEM = DEe + DEv + DEr =hn
Zmeny energie elektrónov (DEe ≈ 150 – 600 kJ mol-1) sú však spravidla omnoho väčšie ako vibračnej energie (DEv ≈ 2 – 60 kJ mol-1) a rotačnej energie (DEr ≈ 3 kJ mol-1), takže rozlišovať ich možno len pri špeciálnych podmienkach ako jemnú štruktúru príslušného spektra.
Ako vidieť na obrázku 4, absorpčné prechody látky môžu prebiehať z rôznych vibračných a rotačných stavov základného elektrónového stavu molekuly do rôznych vibračných a rotačných stavov jej excitovaného elektrónového stavu. Všetky zmeny vibračnej a rotačnej energie sa pripočítajú k energii preskoku elektrónov a vzniká celá sústava spektrálnych čiar, ktorých vlnová dĺžka sa líši len v malej miere. Čiarové spektrá (kvantový charakter absorpcie žiarenia) sa prekrývajú a v spektre sa to prejavuje ako molekulový absorpčný pás.
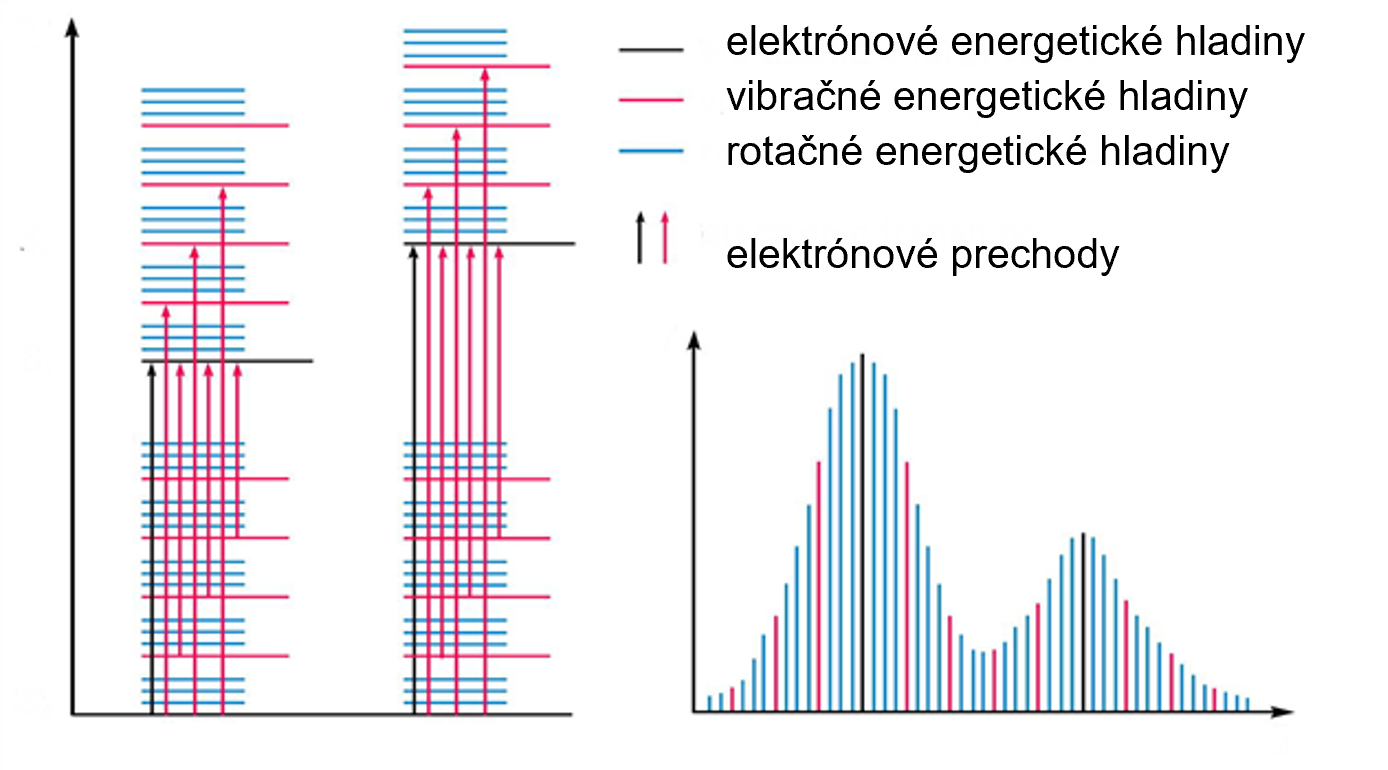
Obr. 4. Vznik molekulového absorpčného pásu
Absorpciu žiarenia látkami len vo viditeľnej časti spektra (380 – 780 nm) môžeme subjektívne pozorovať aj vlastnými očami. Absorpcia v tejto oblasti spektra sa nám javí ako farebnosť látky. Farebná látka absorbuje (pohlcuje) z bieleho (viditeľného) svetla len žiarenie takej vlnovej dĺžky (takej farby), ktorá je doplnkovou (komplementárnou) farbou k farbe látky samotnej. Na tomto jave bola založená najstaršia a najjednoduchšia metodika, kolorimetria, kde detekcia veľkosti absorpcie bola robená ľudským okom. Maximálna spektrálna citlivosť ľudského oka je pri vlnovej dĺžke 550 nm. V súčasnosti sa kolorimetria používa ako orientačná metóda, pomocou ktorej je možné relatívne porovnávať intenzitu zafarbenia roztokov vzoriek a štandardov v celom rozsahu VIS spektra (v komparátoroch).
Na obrázku 5 sú uvedené vlnové rozsahy a farby absorbovaného VIS žiarenia a súčasne doplnkové farby, v akých vidíme látky (napr. zafarbenie roztoku) pri pohltení svetla uvedenej vlnovej dĺžky.

Obr. 5. Farby absorbovaného žiarenia v závislosti od vlnovej dĺžky a ich doplnkové farby
V súčasnosti najpoužívanejší prístroj je spektrofotometer, ktorý umožňuje získať spektra v UV-VIS oblasti. Na obrázku 6 je znázornená základná schéma dvojlúčového spektrofotometra.
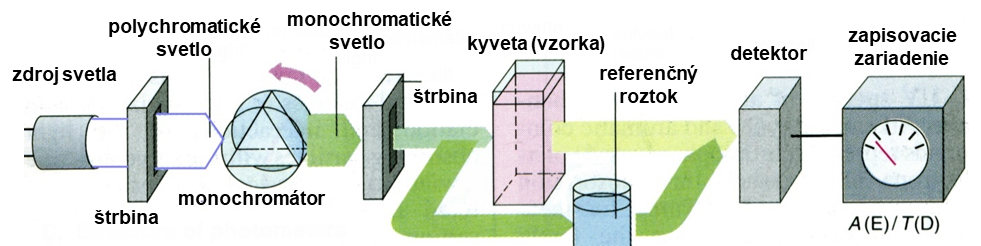
Obr. 6. Schéma dvojlúčového spektrofotometra
Zdroj žiarenia vysiela polychromatické žiarenie (pre UV oblasť sa používajú vodíkové resp. deutériové výbojky a pre VIS oblasť sa používajú volfrámové resp. halogénové žiarovky), ktoré sa na difrakčnej mriežke monochromátora rozkladá a vzniknuté spektrum sa odráža od zrkadla a premieta sa na zadnú stenu monochromátora. Otáčaním mriežky je možné dosiahnuť, aby cez výstupnú štrbinu monochromátora vychádzal lúč o požadovanej vlnovej dĺžke. Lúč prechádza cez absorbujúce prostredia, ktoré sú realizované kyvetami s konštantnou vnútornou hrúbkou absorbujúcej vrstvy od 0,1 do 10 cm. Do jednej kyvety sa umiestni referenčný roztok (zvyčajne je to čisté rozpúšťadlo resp. slepý roztok) a detektor registruje žiarenie o intenzite I0. V druhej kyvete je roztok analyzovanej vzorky a na detektor potom dopadá žiarenie o intenzite I. Objektívne hodnotenie veľkosti absorbancie sa uskutočňuje použitím fotoelektrických detektorov (fotočlánkov) citlivých na UV-VIS žiarenie. Signály z detektora sa pomocou analógovo-digitálneho prevodníka prevedú do počítača, ktorý využitím vhodného programu vyhodnotí analýzu. Ak sa zisťuje priebeh krivky priepustnosti difrakčná mriežka sa otáča a cez výstupnú štrbinu monochromátora postupne vystupujú lúče s klesajúcou vlnovou dĺžkou, ktoré zahŕňa celú spektrálnu oblasť. Pre prácu vo VIS oblasti spektra sa využívajú kyvety zo skla a pri práci v UV oblasti sa používajú kyvety z kremeňa (SiO2).
Spektrofotometria sa využíva v organickej a anorganickej kvantitatívnej a kvalitatívnej analýze. V kvantitatívnej analýze sa miera prepusteného, alebo pohlteného žiarenia sa najčastejšie vyjadruje parametrami ako je transmitancia (priepustnosť) T a absorbancia (pohltenie) A.
Transmitancia T je pomer intenzity absorbovaného žiarenia I a intenzity pôvodného žiarenia I0:
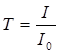 (1)
(1)
Absorbancia A je definovaná ako:
(2) 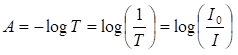
Závislosť transmintancie na vlnovej dĺžke dopadajúceho žiarenia λ sa nazýva krivkou priepustnosti a závislosť absorbancie na vlnovej dĺžke dopadajúceho žiarenia λ sa nazýva absorpčné spektrum. Na obrázku 7 je znázornené absorpčné spektrum a krivka priepustnosti tej istej látky.
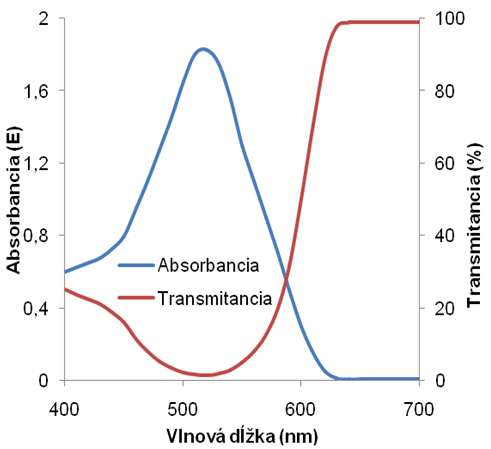
Obr. 7 Absorbancia vs. transmitancia
Maximum absorpcie Amax (Tmin) zodpovedá vlnovej dĺžke, pri ktorej sa dá vykonať kvantitatívna analýza. Pre kvantitatívnu analýzu platí už spomenutý Lambertov-Beerov vzťah, podľa ktorého absorbancia A je úmerná mólovému absorpčnému koeficientu ελ (špecifický pre každý druh molekúl a vlnovú dĺžku), dĺžke absorbujúcej vrstvy l a koncentrácii analyzovanej látky c:
(3) 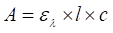
Ak sa stanovujú rovnaké druhy látok ελ v rovnakých kyvetách l vzťah sa zjednoduší:
(4) 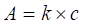
METÓDA VYHODNOTENIA
Metóda kalibračnej krivky je najpoužívanejšia a najvhodnejšia metóda na stanovenie koncentrácie analytu (obrázok 8). V prípade analýzy série podobných vzoriek pre každý analyt je potrebné zostrojiť zvláštnu kalibračnú závislosť. Kalibračná závislosť pre analyt sa získava meraním signálov analytu v roztokoch S, ktoré majú rovnaké priemerné zloženie ako vzorky, ale s odstupňovanou, známou koncentráciou analytu c. Kalibračné závislosti prechádzajú počiatkom osí a až po určitú koncentráciu majú lineárny charakter. Oblasť nad touto koncentráciou sa obyčajne už nevyužíva pre odčítanie príslušnej koncentrácie, nakoľko odčítanie je zaťažené veľkou neistotou. Preto sa často využíva postup riedenia vzoriek, ktorých signál presiahol bod určený hodnotou c. Zriedená vzorka musí mať signál, ktorý sa dá vyhodnotiť pomocou lineárnej oblasti kalibračnej závislosti. Priebeh kalibračnej závislosti zahŕňa vplyv matricového efektu na meraný signál.
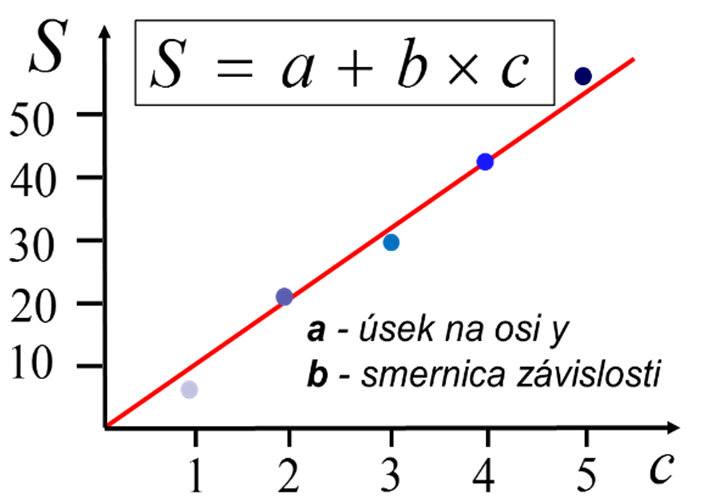
Obr. 8. Znázornenie metódy kalibračnej krivky
Experimentálna časť
Úlohy
1. Zmerajte UV-VIS spektrum vodného extraktu získaného macerovaním vzorky červenej repy (kocka s hranou cca 1 cm) po dobu minimálne 5 minút a určite vlnovú dĺžku absorpčného maxima (maxím) λmax.
2. Overte platnosť Lambertovho - Beerovho zákona pre daný konkrétny postup zrieďovaním pôvodného extraktu minimálne 3 x vždy na polovicu a zostrojte kalibračnú čiaru A = f( zrieďovací faktor).
3. Stanovte neznámu koncentráciu betanínu v extrakte a vyjadrite ju ako pomerné číslo k pôvodnej koncentrácii považovanej za jednotkovú.
Roztoky, prístroje a zariadenie
Destilovaná voda, roztok HCl 0,1 mol dm-3 , roztok NaOH 0,1 mol dm-3 , spektrofotometer Shimadzu, sklené a kremenné kyvety (d = 1 cm), kadičky, odmerné valce, pipety
Pracovný postup
1. Zo zásobníka deionizovanej vody odpipetujeme 10 cm3 do kadičky objemu 25 cm3. Pridáme z červenej repy vyrezanú 1 kocku s objemom približne 1 cm3 a macerujeme ju po dobu minimálne 5 minút. Po uplynutí tejto doby zlejeme časť červenkasto sfarbenej tekutiny do ďalších 3 kadičiek tak aby v každej bol objem vodného extraktu približne 3 cm3.
2. Z prvej kadičky odlejeme roztok do plastovej alebo sklenej (prípadne kremennej) meracej kyvety tak, aby vyplnil priestor do výšky minimálne 5 mm nad rysku označujúcu minimálnu výšku hladiny meranej tekutiny, ktorá zabezpečí správne meranie.
3. Odmeriame spektrum betanínu vo viditeľnej oblasti spektra od 400 nm do 750 nm.
4. Z kyvety zlejeme extrakt späť do pôvodnej (prvej) kadičky a pridáme k 3 cm3 roztoku pipetou presne 1 cm3 deionizovanej vody, premiešame a opäť odmeriame spektrum.
5. K druhému podielu vzorky pridáme presný objem 1 cm3 roztoku 0,1 mol dm-3 HCl, zamiešame pričom pozorujeme zmenu sfarbenia betanínu v extrakte červenej repy.
6. Z druhej kadičky odlejeme roztok do sklenej (prípadne kremennej) meracej kyvety tak, aby vyplnil priestor do výšky minimálne 5 mm nad rysku označujúcu minimálnu výšku hladiny meranej tekutiny, ktorá zabezpečí správne meranie.
7. K tretiemu podielu vzorky pridáme presný objem 1 cm3 roztoku 0,1 mol dm-3 NaOH, zamiešame a pričom pozorujeme zmenu sfarbenia betanínu v extrakte červenej repy.
8. Z tretej kadičky odlejeme roztok do plastovej alebo sklenej (prípadne kremennej) meracej kyvety tak, aby vyplnil priestor do výšky minimálne 5 mm nad rysku označujúcu minimálnu výšku hladiny meranej tekutiny, ktorá zabezpečí správne meranie.
9. Poznámka k meraniu spektier: meraciu kyvetu niekoľkokrát vypláchneme meraným roztokom, ktorý vždy zlejeme späť do kadičky. Kyvetu s roztokom vložíme do registračného spektrofotometra a premeriame závislosť A = f(l) v rozsahu 400 – 750 nm. Ako porovnávací roztok použijeme deionizovanú vodu. Meriame podľa návodu na obsluhu prístroja, prípadne podľa pokynov vyučujúceho. Z nameraného spektra (graf závislosti A = f(l)) určíme vlnovú dĺžku maxima lmax, prípadne maxím.
10. Diskutujte vzťah farebných zmien pri rôznych hodnotách pH. Pokúste sa vysvetliť prečo dochádza k farebným zmenám v súvislosti so zmenami chemickej štruktúry betanínu.
11. Zrieďujte opakovane pôvodný vodný extrakt červenej repy vždy na polovicu a odmerajte spektrum za definovaných podmienok zriedenia. Postup opakujte až pokiaľ nebudete schopní odlíšiť spektrum od nulovej línie. To znamená, keď sú vlastnosti veľmi zriedeného extraktu zdanlivo totožné s vlastnosťami deionizovanej vody v porovnávacej kyvete.
12. Zostrojte kalibračnú závislosť ako vzťah A(lmax) = f(zrieďovací faktor), pričom zrieďovací faktor bude mať hodnotu 1 pre nezriedený extrakt, 0,5 pre pôvodný extrakt zriedený na polovicu, 0,25 pre pôvodný extrakt zriedený na jednu štvrtinu a tak ďalej.
13. Diskutujte platnosť Lambertovho-Beerovho zákona a zostrojenú kalibračnú závislosť použite na zistenie neznámeho zrieďovacieho faktora vo vzorke.
Návod spektrofotometer Pasco
Spektrofotometer je optický prístroj ktorý slúži na meranie UV-VIS spektier látok, ktoré majú schopnosť pohlcovať elektromagnetické žiarenie v uvedených oblastiach spektra. Slúži aj na meranie priepustnosti resp. absorbancie UV-VIS žiarenia chemickými látkami, ktoré obsahujú chromofóry.

Bezdrôtový Vis spektrofotometer Pasco
Súbor na stiahnutie
Návod spektrofotometra PascoMetodika pre učiteľa
Výskumná otázka
Ako zistíme koncentráciu malého množstva látky prítomného vo farebnom roztoku ?
Teoretický úvod

Obr. 1 e-protokol v Sparkvue
Obr. 2 Teoretický základ ku spektrometrii
Rozširujúce informácie pre učiteľa
sPri absorpčnom meraní sa sleduje úbytok toku žiarenia určitej vlnovej dĺžky l po prechode prostredím s analyzovanou látkou. Mierou intenzity absorpcie je transmitancia T (priepustnosť). Táto veličina je daná pomerom toku žiarenia prepusteného absorbujúcou sústavou F k toku vstupujúcemu F0:
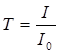 (1)
(1)
a často sa vyjadruje v %. Udáva koľko % svetelnej energie absorbujúca vrstva prepúšťa.
Dekadický logaritmus prevrátenej hodnoty T sa nazýva absorbancia A:
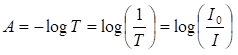
(2)
Vzťah medzi absorpciou svetelného žiarenia, vyjadrenou ako absorbancia A, koncentráciou absorbujúcej látky c a hrúbkou vrstvy absorbujúceho prostredia d vyjadruje Lambertov – Beerov zákon:
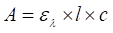
(3)
e je molový absorpčný koeficient, ak koncentrácia je vyjadrená v mol.dm-3, A, e sú funkcie vlnovej dĺžky používaného žiarenia.
Základným predpokladom akéhokoľvek spektrofotometrického merania je platnosť Lambertovho – Beerovho zákona. Priama úmernosť medzi absorbanciou A a koncentráciou c, ak d = konštantné, platí presne len pre monochromatické žiarenie a pre malé koncentrácie analyzovanej látky (< 10-2 mol.dm-3), keď hodnota e je konštantná. Ak v roztoku nie je prítomná žiadna ďalšia látka absorbujúca žiarenie, priamka prechádza počiatkom. Hodnota e určuje citlivosť stanovenia.
Za prítomnosti 2 alebo viac absorbujúcich zložiek platí aditivita dielčích absorbancií a celková nameraná absorbancia je potom daná vzťahom:
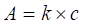
(4)
Ak chceme použiť spektrofotometriu na stanovenie látok, musíme najskôr premerať závislosť A = f(l), kde l je vlnová dĺžka použitého monochromatického svetla. Grafickým znázornením tejto závislosti je absorpčná krivka nazývaná tiež spektrálna závislosť. Z absorpčnej krivky zistíme, aké svetlo meraná látka najviac absorbuje – lmax. Po zistení lmax si pripravíme sériu roztokov so stúpajúcou a presne známou koncentráciou absorbujúcej látky a zmeriame ich absorbanciu pri tejto vlnovej dĺžke. Zostrojením závislosti A = f(c) overíme platnosť Lambertovho – Beerovho zákona v danom systéme a súčasne získame kalibračnú krivku pre stanovenie neznámej koncentrácie absorbujúcej látky. Po zmeraní absorbancie roztoku analyzovanej látky, ktorý sa pripravil rovnakým spôsobom ako roztoky kalibračné, sa z kalibračnej krivky určí jej koncentrácia.
Prakticky každá látka absorbuje žiarenie emitované v ultrafialovej oblasti žiarenia, pretože pre fotóny so zodpovedajúcou energiou býva splnená rezonančná podmienka na excitáciu elektrónov nachádzajúcich sa v elektrónových štruktúrach atómov, iónov, molekúl alebo funkčných skupín (atómové orbitaly, molekulové orbitaly). Následkom toho je veľká pravdepodobnosť, že rôzne látky prítomné v rozpustenej vzorke, vrátane rozpúšťadla, budú rušiť (interferovať) analytický signál meranej látky (analytu). Preto je táto oblasť žiarenia využívaná veľmi často v kombinácii so separačnými metódami. Najviac aplikácii spektrofotometrie vo viditeľnej oblasti spektra je zameraná na priame meranie farebných látok, ktorých je však podstatne menej ako látok, ktoré je potrebné stranoviť pomocou spektrofotometrie alebo fotometrie (kolorimetrie) vo viditeľnej oblasti elektromagnetického žiarenia. Preto je nutné zmeniť bezfarebné zlúčeniny vhodnou reakciou na farebné látky. Pri stanovení kovov sa napríklad katióny kovov premenia na rozpustné farebné stabilné komplexy (napr. Cu2+, Ni2+ na modrofialové aminokomplexy) alebo cheláty.
Na meranie absorpčných spektier analyzovaných látok a na stanovenie ich koncentrácie vo vzorke sa používajú prístroje – spektrofotometre. V analytických laboratóriách na stanovenie koncentrácií látok z hodnôt absorbancií sa väčšinou používajú neregistrujúce a konštrukčne jednoduchšie jednolúčové prístroje. Spektrofotometer PASCO SPECTROMETER PS-2600 Wireless Spectrometer and Fluorometer.má 4 základné časti:
Zdroj(e)- žiarenia svetlo emitujúce diódy LED s diskrétnymi emisnými spektrami ( rôznofarebné LED),
absorbujúci systém – roztok v kyvete,
fotometrický systém, ktorý sa skladá z fotoelektrického detektora, zosilňovača a meracieho prístroja.
Počítač na zobrazovanie spektra a vyhodnocovanie výsledkov meraní.
Stupnica meracieho prístroja je kalibrovaná v jednotkách absorbancie a priepustnosti. V poslednom čase sa používajú meracie prístroje s digitálnym výstupom.
Schéma zapojenia uvedených častí u jednolúčového spektrofotometra je na obrázku 3.
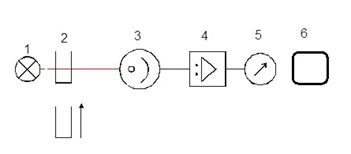 Obr. 3 Schéma jednolúčového LED spektrofotometra. 1 - zdroj žiarivej energie 1 a viac LED, 2 – kyveta so vzorkou, 3 - detektor svetla (fotónov – fototranzistor, fotónka, fotonásobič) 4 – zosilňovač, 5 - merací prístroj, 6 – počítač
Obr. 3 Schéma jednolúčového LED spektrofotometra. 1 - zdroj žiarivej energie 1 a viac LED, 2 – kyveta so vzorkou, 3 - detektor svetla (fotónov – fototranzistor, fotónka, fotonásobič) 4 – zosilňovač, 5 - merací prístroj, 6 – počítač
V jednolúčových prístrojoch vkladáme do dráhy svetelného lúča striedavo kyvetu s porovnávacím a meraným roztokom. Na základe porovnania ich absorpcie určíme absorbanciu meranej látky. Takýmto spôsobom sa eliminujú všetky negatívne vplyvy, ktoré ovplyvňujú absorpciu svetla spôsobenú meranou látkou. Porovnávací roztok obsahuje všetky zložky meraného roztoku, okrem meranej látky. Niekedy sa v literatúre označuje ako "blank" alebo "slepý roztok".
Otázky
Čo sú prírodné farbivá ?
Viete aké prírodné farbivo je v červenej repe ?
Prírodné farbivá sú prirodzenou súčasťou prírody okolo nás. V zložitom systéme vzťahov medzi biologickými objektami majú veľa úloh, ktoré sú častokrát aj veľmi zvláštne. Chlorofyly, karotenoidy, xantogény sú súčasťou systémov zachytávajúcich energiu slnečného žiarenia (fotónov) vo fotosyntetických aparátoch rastlín. Podobnú funkciu v energetickom systéme živočíchov ale zameranú na transport kyslíka majú hemoglobín a iné krvné farebné látky.
Betanín, je červené glykozidové potravinárske farbivo získavané z červenej repy (Beta vulgaris). Aglykón (časť molekuly farbiva bez sacharidovej časti) betanínu získaný hydrolýzou a oddelením molekuly glukózy sa nazýva betanidín a ako potravinárske farbivo má značku E162.
Betanín sa obyčajne získava z extraktov šťavy červenej repy. Hmotnostná koncentrácia betaninu v červenej repe sa pohybuje v rozmedzí 300–600 mg/kg. Okrem uvedeného zdroja sa nachádza spolu so sprievodnými betalainmi aj v plodoch – kaktusových figách opuncií (Opuntia ficus-indica), v kvetoch, plodoch a listoch stromov amaranth (napríklad Amaranthus caudatus) a mnohých iných zo 44 zástupcov tohto druhu.
Rozširujúce informácie o betaníne pre učiteľa
Betanín sa používa hlavne na dofarbovanie mrazených potravín, potravín predávaných v suchom stave a tiež potravín, ktoré majú definovanú krátku dobu od výroby do spotreby. Používa sa tiež na dofarbovanie mäsa a párkov, zmrzlín, cukríkov, krémov, ovocných drení a náplní, paradajkových pretlakov polievok a mnohých iných potravín. Betanín sa neznehodnocuje ani pasteurizáciou, napriek pôsobeniu vysokých teplôt, pokiaľ je v prostredí s vysokým obsahom cukrov. Betanín sa v črevách dobre absorbuje a priaznivo pôsobí ako antioxidant. Po jeho konzumácii môžeme pozorovať jeho prítomnosť v moči a stolici na základe ich charakteristického sfarbenia.
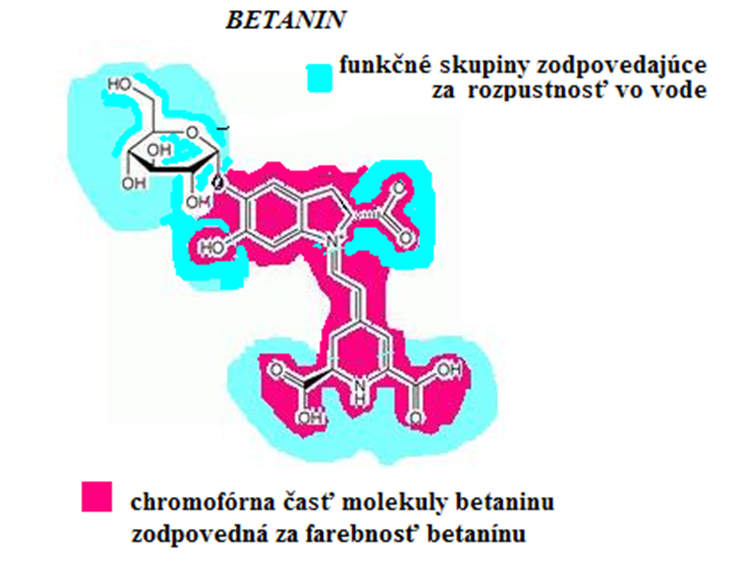 Obr. 4 Sumárny vzorec: C24H27N2O13, mólová hmotnosť: 551,48 g/mol
Obr. 4 Sumárny vzorec: C24H27N2O13, mólová hmotnosť: 551,48 g/mol
Betanín nemá prakticky žiadne alergizujúce účinky na organizmus. Betanín sa rozkladá, pri tom sa chemická štruktúra betanínu mení pôsobením svetla, pôsobením tepla pri zohrievaní a vplyvom vzdušného kyslíka. Jeho citlivosť na oxidáciu kyslíkom je najväčšia pri potravinách s vysokým obsahom vody a v prítomnosti niektorých katiónov kovov (napr., železa a medi). Tento proces tiež spomaľujú antioxidanty, napríklad kyselina askorbová. Betaín je v suchom stave odolný aj voči pôsobeniu vzdušného kyslíka. Uvedené skutočnosti jasne poukazujú na potrebu analýzy betaínu v rôznych vzorkách a v rôznorodých súvislostiach.
Sfarbenie roztokov betanínu závisí od kyslosti roztoku (pH). Pri hodnotách pH v rozmedzí 4.0 až 5.0 je roztok betanínu jasne modročervený ale pri zvyšovaní hodnoty pH sa stáva modrofialovým. Pri ďalšom zvyšovaní pH do alkalickej oblasti betanín začína hydrolyticky degradovať čo má za následok zmenu sfarbenia roztoku na žltú farbu a ďalej na hnedú farbu. Betanin je betalainové farbivo a v červenej repe sa okrem neho nachádzajú v menšom zastúpení aj izobetanin, probetanin, neobetanin, a farbivá s odlišnou chemickou štruktúrou eindicaxanthin a vulgaxanthíny.

Obr. 5 Chemický názov betanínu: 4-(2-(2-karboxy-5-(beta-D-glukopyranozyloxy)-2,3-dihydro-6-hydroxy-1H-indol-1-yl)etenyl)-2,3-dihydro-(S-(R*,R*))-2,6-pyridíndikarboxylová kyselina
Pomôcky a materiály
Laboratórne pomôcky a materiály:
- 5x 25 ml kadička
- 3x pipety
- 6 plastových kyviet
- d = 1
- sklená tyčinka
- destilovaná voda
- laboratórny plášť
- 1 ks červenej repy
- jednorázové gumenné rukavice
- strúhadlo na
- hranolky (alebo nôž)
Obr. 6 Laboratórne pomôcky (Beljička, 2019)
Digitálne pomôcky:
- PASCO SPECTROMETER PS-2600
- tablet, iPad
- Softvér Sparkvue 4.2.0
- Softvér Word Microsoft Office 365
- Softvér Spectrometry 2.2.0

Obr. 7 Digitálne pomôcky (https://www.pasco.com/prodCatalog/PS/PS-2600_wireless-spectrometer/index.cfm)
Bezpečnosť
Experiment/bádanie je z hľadiska bezpečnosti nenáročný, študenti pracujú s roztokmi HCl 0.1 mol.dm-3 a NaOH 0.1 mol.dm-3 s vodou a s roztokmi červenej repy. Treba dávať pozor hlavne na bezpečnosť práce pri manipulácii s roztokmi kyseliny chlorovodíkovej a roztokom hydroxidu sodného.
Správny postup pri práci s technikou
Pred vyučovacou hodinou učiteľ pripraví:
- Tablety (nabije) a nahrá do nich iPL pre daný experiment
- (e-protokoly).
- Pasco wireless spektrometery
- Všetky potrebné laboratórne pomôcky
- Dôkladne si naštuduje prácu v softvéri SPARKvue a Spectometry
Dôležité! Kyvety do spektometra chytajte iba za drážkovanú časť, svetelný lúč musí prechádzať čírou časťou zľava doprava ako je to naznačené na vrchnej doske prístroja.
Pracovný postup pre prípravu vzoriek na experimentálne meranie a samotný experiment
Ako merať absorpčné spektrá betanínu vo vzorkách s rôznym počtom kociek červenej repa so Spektrometrom Pasco
Wireless spektrometer je nový prístroj na trhu a predpokladáme, že učitelia aj študenti nemajú skúsenosti a zručnosti práce s ním, tak sme pripravili video manuál (dva videá) krok po kroku ako realizovať experiment.
Učiteľ aj študent si naštudujú video manuál a prejdú zo softvérového prostredia Sparkvue do softvéru Spektrometry, kde realizujú všetky merania a výsledky si môžu odfotografovať, alebo s programom Snip zachytiť a vložiť do e-protokolu v Sparkvue a uložiť celý protokol na cloud.
Stručný postup práce z video manuálu
- Urobíme si kocky cvikly 1cm3 (pomocou rezača na hranolky, alebo iného rezača) a zalejeme 15 ml destilovanej vody (1nádoba 1 kocka, potom 2,3,4,5 kociek) Obrázok xx. Vyluhujeme 15 min. (Obrázok xx)
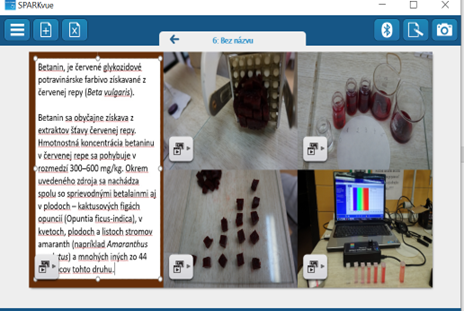
Obr. 8 Príprava roztokov z črvenej repy na meranie absorpčných spektier betanínu
- Po vyluhovaní z jednotlivých roztokov odlejeme do pripravených kyviet roztoky betanínu a označíme si ich podľa koncentrácie (t.j. počtu kociek červenej repy v roztoku od čísla 1 do 5).
- Pred meraním musíme nakalibrovať prístroj. Pripravíme si na to kyvetu č.1 s destilovanou vodou. A kyvetu č.6 s najväčšou koncentráciou betanínu (č.5).
- Pripravíme si ešte jednu kyvetu č.7, kde bude neznáma koncentrácia betanínu, ktorú mámú študenti experimentálne zistiť (pripraviť môžeme pre každého študenta inú vzorku, tak že do kyvety (pre určenie koncentrácie betanínu v neznámej vzorke) s pipetou naberieme časť výluhu z dvoch alebo troch vzoriek betanínu (napríklad naberieme do kyvety niekoľko mililitrov výluhu betanínu kde boli 2 kocky červenej repy a ďalšie mililitre z výluhu betanínu kde boli 4 kocky červenej repy). Takto môžeme pripraviť rôzne vzorky na meranie pre jednotlivé dvojice študentov.
- Keď máme pripravené vzorky (obrázok xy), otvoríme si program Spectometry, pripojíme wireless spektrometer a spustíme meranie absorbancie jednotlivých vzoriek. Najprv si nakalibrujeme prístroj zmeraním roztokov vzoriek č.1 a č.6 a potom už postupne meriame absorbčné spektrá jednotlivých roztokov betanínu č.5 až č.2. Postupujeme podľa video manuálu. (Študenti si odfotografujú kalibráciu prístroja a merania absorbancií vzoriek a vložia obrázokx do vyznačených listoch vprostredí e-protokolu SPARKvue).
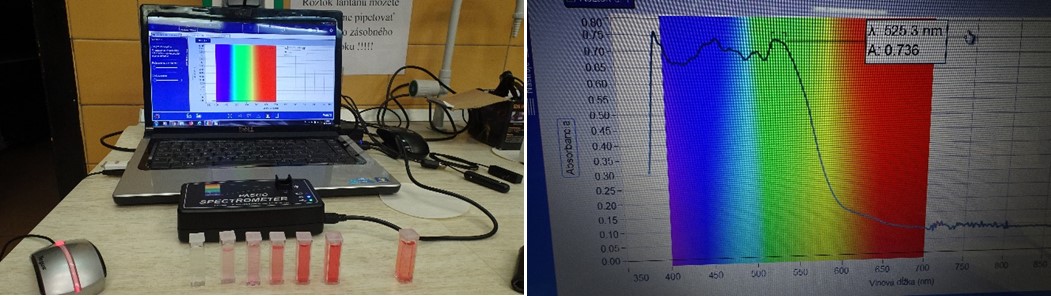
Obr. 9 Kalibrácia spektrometra - softvér Spektrometry
- Po nameraní absorpčných spektier všetkých roztokov betanínu zostrojíme kalibračnú krivku na ktorej vidíme lineárny priebeh závislosti absorbancie od koncentrácie látky (Obrázok xz). Diskutujte platnosť Lambertovho-Beerovho zákona a zostrojenú kalibračnú závislosť použite na zistenie neznámej koncentrácie betanínu vo vzorke č.7 extraktu červenej repy. (Študenti si odfotografujú kalibračnú krivku a vložia obrázok do vyznačeného listu v prostredí e-protokolu SPARKvue).
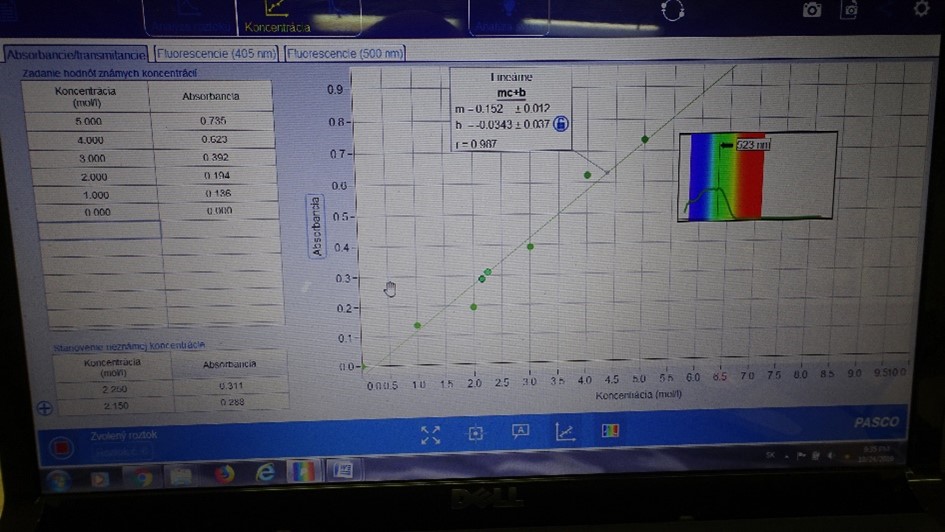
Obr. 10 Zostrojenie kalibračnej krivky
- V spektrometri zmeriame poslednú vzorku v kyvete č.7. (Študenti si odfotografujú nameranú koncentráciu betanínu v neznámej vzorke a vložia obrázok do vyznačeného listu v prostredí e-protokolu SPARKvue). ˇ
- Študenti s uložia svoje meranie v prostredí Spectrometry (Uložiť ako) do vytvoreného priečinka na hard disk.
- Diskutujte so študentami čo vedia vyčítať z nameranej závislosti. Aká je hodnota korelačného koeficientu. Aké presné hodnoty koncentrácie betanínu boli namerané.
- Študenti majú všetky závery z experimentu a zistenia zaznamenať v softvérovom prostredí SPARKvue. Po vyplnení všetkých listov v e-protokole, uložia študenti protokol podľa inštrukcií (Obrázok xw).
Obr. 11 Ukladanie protokolov (Brestenská , Beáta 2019)
Úlohy pre študentov
1. Zmerajte absorpčné spektrum vodného extraktu získaného macerovaním vzorky červenej repy (kocka s hranou cca 1 cm) po dobu minimálne 5 minút v destilovanej vode a určite vlnovú dĺžku absorpčného maxima (maxím) λmax.
2. Overte platnosť Lambertovho - Beerovho zákona pre daný konkrétny postup zrieďovaním pôvodného extraktu minimálne 3 x vždy na polovicu a zostrojte kalibračnú čiaru A = f( zrieďovací faktor).
3. Stanovte neznámu koncentráciu betanínu v extrakte a vyjadrite ju ako pomerné číslo k pôvodnej koncentrácii považovanej za jednotkovú.
Analýza získaných výsledkov
Študenti majú v e-protokole v Sparkvue otázky, zamerané na analýzu dát, ktoré vyplnia a učiteľovi poskytujú spätnú väzbu o tom, na akej úrovni študent pochopil učivo, ktoré záskaval samostatným bádaním. Otázky sú zamerané hlavne na pochopenie princípu spektrálnej optickej metódy – spektrometrie pre zisťovanie malých koncentrácií látok vo farebných roztokoch.
Záver
Po vykonaní experimentu/riadeného bádania, nasleduje sebahodnotenie študenta (nástroj formatívneho hodnotenia) , kde učiteľ získava podrobné hodnotenie ako sa študentovi pracovalo s digitálnymi technológiami pri experimente, čo sa naučil a čo bolo preňho nové, aký progres vo vedomostiach a zručnostiach získal, čo mu robilo problémy a i.
Odporúčané témy pre ďalšie experimenty:
Zistite ako sa zmení sfarbenie betanínu vo vzorke roztoku s 5 kockami červenej repy ak tento roztok rozdelíte do dvoch kadičiek a do prvej kadičky pridáte presný objem 1 cm3 roztoku 0,1 mol.dm-3 HCl a do druhej kadičky pridáte presný objem 1 cm3 roztoku 0,1 mol.dm-3 NaOH. Zmerajte absorbčné spektrá oboch roztokov betanínu s rôznym pH (ako porovnávací roztok použite destilovanú vodu). Pokúste sa vysvetliť prečo dochádza k farebným zmenám roztokov betanínu ak zmeníme pH pôvodného roztoku betanínu.
-
- Navrhnite ďalšie potraviny, kde sa nachádzajú prírodné farbivá a ktoré by ste mohli použiť namiesto červenej repy.
- Zistite aké chemické zloženie majú používané potravinárske farbivá a z čoho sa získavajú.
- Navrhnite ďalšie experimenty na meranie absorpčných spektier prírodných farbív.
Literatúra
Labuda J., a kolektív: Analytická chémia, ALFA/SNTL, Bratislava 2019.
 STEM
STEM